
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1. 银单质
(47Ag)是第五周期Ib族元素,在自然界有游离态的银。银的活动性在氢之后,在电化学中,Ag是活性电极,在阳极放电:Ag-e-=Ag+。
Ag2O对热不稳定,加热到时完全分解:
2Ag2O 4Ag+O2↑。
4Ag+O2↑。
乙醇在单质Ag或Cu催化下,可被氧化成乙醛,其催化原理是:
4Ag+O2 2Ag2O
2Ag2O
C2H5OH+Ag2O 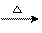 CH3CHO+2Ag+H2O
CH3CHO+2Ag+H2O
银器表面变暗,主要是由于生成了Ag2S所致,为使其表面恢复光泽,可将其放入盛食盐水的铝盆中,发生原电池反应:
负极(Al):2Al-6e-=2Al3+
正极(Ag2S):3Ag2S+6e-=6Ag+S2-,
S2-+2Al3++6H2O=2Al(OH)3↓+3H2S↑
总反应:2Al+3Ag2S+6H2O=2Al(OH)3↓+6Ag+3H2S↑
2.氢氧化银(AgOH)的性质
在AgNO3溶液中,逐滴加入稀氨水,首先生成白色沉淀AgOH↓,AgOH极不稳定,立即脱水生成暗棕色的Ag2O 沉淀,AgOH及Ag2O均能溶于氨水形成银氨溶液:
AgNO3+NH3·H2O=AgOH↓+NH4NO3
AgOH+2NH3·H2O=Ag(NH3)2OH+2H2O
3.银盐
多数银盐难溶于水,能溶的只有AgNO3、AgF、AgSO4等少数几种。
在卤化银中,除AgF外,AgCl(白↓)、AgBr(淡黄↓)、AgI(黄↓)均不溶于水且不溶于稀HNO3。
常见难溶银盐的溶解度大小为:S(AgCl)>S(AgBr)>S(AgI)>S(Ag2S)
依次加入Br-、I-、S2-可实现沉淀转化:AgCl→AgBr→AgI→Ag2S。
AgCl、AgBr、AgI都具有感光性。
照像底片及印相纸上都散布着细小的AgBr明胶,摄影时,受光线照射而分解成细小的银:
2AgBr 2Ag+Br2;
2Ag+Br2;
AgI可用于人工降雨。硝酸银见光或加热容易分解:
2AgNO3=2Ag+2NO2+O2↓
因此AgNO3晶体或溶液应装在棕色试剂瓶中。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【导读】“强酸制弱酸”是复分解反应的常见规律,其本质是强酸电离出的H更易与弱酸根...
在高中化学中,很多同学从初中就学习了复分解反应, 都知道复分解反应中“强酸制弱酸...
1.水银:汞Hg 2.过氧一硫酸:过氧硫酸过硫酸 H 2 SO 5 3.白金:主要成分铂 Pt 4.苯:C...
...
元素种类 对应物质的常考易错点 N 性质:(1)浓HNO 3 和Cu(足量)在反应时,随反应进行...
例题1:浓硫酸与金属反应的条件 题目:常温下,浓硫酸能否与金属铁发生反应? 错误答...