
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
无水氯化铜是棕黄色的,氯化铜晶体(CuCl2· 2H2O)是绿色的,根本原因在于它们的结构不同。
CuCl2是共价型分子,具有链状结构(如图1所示),以(CuCl2)n形式存在,具有挥发性。它具有很强的吸湿性,吸收水分子形成结晶氯化铜,结晶氯化铜是平面型结构(如图2所示),所以二者颜色不同。
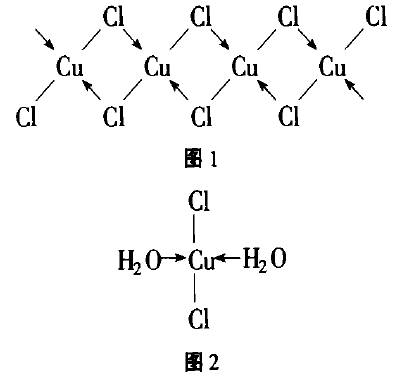
无水氯化铜溶于少量水时形成[Cu(H2O)4 ]2+ (显蓝色)和[CuCl4]2-(显黄色)络离子:
(CuCl2)2+4H2O==[Cu(H2O)4]2++[CuCl4]2-
它们共存时的混合色就是绿色,所以浓的氯化铜溶液显黄绿色,稀释时由于水量增加,电离平衡:
[CuCl4]2-+4H2O  4Cl-+[Cu( H2O)4]2+
4Cl-+[Cu( H2O)4]2+
向右移动,[CuCl4]2-减少,[Cu(H2O)4]2+ 增多,绿色向蓝色变化。在相当稀的CuCl2溶液中,以[Cu(H2O)4 ]2+ 为主,[CuCl4]2-较少,因而溶液显蓝色。
下图由广西南宁梁恒老师提供:



 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一、普鲁士蓝简介 普鲁士蓝(Prussian blue,简称PB),化学名称为亚铁...
...
近日看见一些老师讨论黄铜矿中Fe价态,觉得一些老师可能会有...
清洗银器 黑银是由于氧化所致,氧化银(Ag 2 O)是黑色的故银的表...
金(gold)一种化学元素,符号是Au,荷电核数为79,原子量为1...
先讲一个问题,天然碱式碳酸铜没有固定的化学组成?天然的碱...