
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
离子交换膜是一种具有选择透过性的高分子聚合物膜,也称为离子选择透过性膜.离子交换膜具有非常广泛的应用,它是分离装置、提纯装置以及电化学组件中的重要组成部分,在氯碱工业、水处理工业、重金属回收、湿法冶金以及电化学工业等领域都起到举足轻重的作用.
离子交换膜按功能及结构的不同可以分为多种类型,中学化学中涉及的主要有质子交换膜、阳离子交换膜和阴离子交换膜.质子交换膜只能让质子(H+)和水分子自由通过,其它离子和气体分子不能通过;阳离子交换膜可以让阳离子和水分子自由通过, 而阴离子和气体分子不能通过;阴离子交换膜可以让阴离子和水分子自由通过,而阳离子和气体分子不能通过.
由于离子交换膜在化学工业,尤其在电化学工业中扮演着越来越重要的角色,在近年高考试题中也多次出现了联系工业生产实际,带离子交换膜的电化学装置.
一、离子交换膜在原电池中的应用
在原电池中,离子交换膜的作用与盐桥相似,将原电池分为正半电池和负半电池,从而提高原电池的工作效率.
例1 (2015年全国卷I)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图1所示.下列有关微生物电池的说法错误的是( )
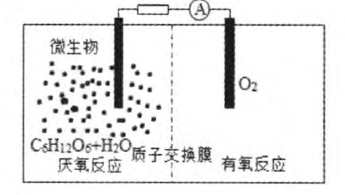
图1
(A)正极反应中有CO2生成
(B)微生物促进了反应中电子的转移
(C)质子通过交换膜从负极区移向正极区
(C)电池总反应为:C6H12O6+6O2=6CO2+6H2O
分析:在原电池中,负极发生氧化反应,正极发生还原反应.由图可知:通氧气的一极为正极,加葡萄糖的一极为负极;在原电池内部,阳离子向正极移动,故质子(H+)由负极区通过质子交换膜移向正极区.
(A)根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O—24e-=6CO2+24H+ 正极的电极反应式为O2+4e-+4H+=2H2O 因此CO2在负极产生,故(A)错误.
(B)葡萄糖在微生物的作用下将化学能转化为电能,形成原电池,有电流产生,所以微生物促进了反应中电子的转移,故(B)正确.
(C)通过原电池的电极反应可知,负极区产生了H+,根据原电池中阳离子向正极移动,可知质子(H+)通过交换膜从负极区移向正极区,故(C)正确.
(D)该反应属于燃料电池,燃料电池的电池反应式和燃烧反应式相同,则电池反应式为C6H12O6+6O2=6CO2+6H2O
故(D)正确.
答案:(A)
技巧提醒
(1)在原电池中,正极区的阴离子通过阴离子交换膜到负极区;负极区的阳离子通过阳离子交换膜到正极区.
(2)相同时间内,外电路中通过电子所带电量等于内电路中通过离子交换膜的离子所带电量.
(3)如果为质子交换膜,一般负极反应要生成H+,正极反应要消耗H+.
二、离子交换膜在电解装置中的应用
在电解装置中,根据不同的生产目的,可以选用一种或多种离子交换膜,将电解池隔成不同的室,从而得到不同的生产产品.
例2 (2015年福建)某模拟“人工树叶”电化学实验装置如图2所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
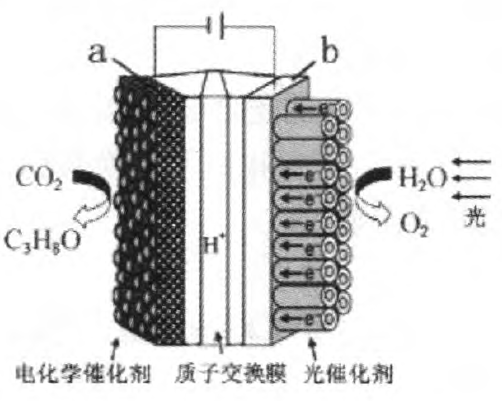
(A)该装置将化学能转化为光能和电能
(B)该装置工作时,H+从b极区向a极区迁移
(C)每生成1 mol O2,有44 g CO2被还原
(D)a电极的反应为:3CO2+18H+-18e-= C3H8O+5H2O
分析:由图可知,该装置为电解装置,a为阴极,电极反应式为: 6CO2+36H++36e-=2C3H6O+10H2O
b为阳极,电极反应式为: 18H2O—36e-=9O2 +36H+
在电解质溶液中,阳离子向阴极移动,阴离子向阳极移动,故在该装置中质子(H+)由阳极区通过质子交换膜进入阴极区.
(A)该装置是电解池装置,是将电能转化为化学能,所以该装置将光能和电能转化为化学能,故(A) 错误.
(B)a与电源负极相连,所以a是阴极b是阳极,而电解池中氢离子向阴极移动,所以H+从阳极b极区向阴极a极区迁移,故(B)正确.
(C)电解总的方程式为: 6CO2+8H2O C3H8O+9O2
C3H8O+9O2
即生成9 mol 的氧气,阴极有6mol 的二氧化碳被还原, 也就是生成1 mol 的氧气,阴极有mol的二氧化碳 被还原,所以被还原的二氧化碳为29.3 g,故(C) 错误.
(D)a与电源负极相连,所以a是阴极,发生还原反应,电极反应式为:3CO2+18H++18e-=C3H8O+5H2O
故(D)错误.
答案:(B)
例3 (2016年全国卷I)三室式电渗析法处理含Na2SO4。废水的原理如图3所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )
(A)通电后中间隔室的SO42-向正极迁移,正极区溶液pH增大
(B)该法在处理含Na2SO4。废水时可以得到NaOH和H2SO4产品
(C)负极反应为2H2O-4e-=O2 +4H+,负极区溶液pH降低
(D)当电路中通过1mol 电子的电量时,会有0.5 mol 的O2生成
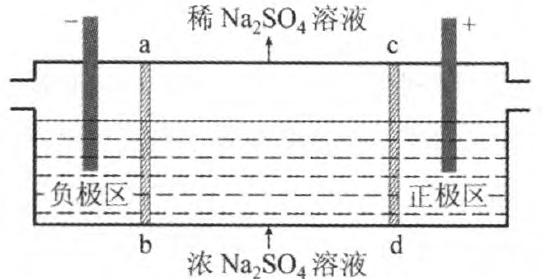
分析:在电解池中,阴离子向阳极(正极区)移动;阳离子向阴极(负极区)移动.中间隔室的Na+通过ab 膜进入负极区,故ab为阳离子交换膜,在阴极,溶液中的H+放电,溶液呈碱性,得到NaOH溶液;SO42-通过cd膜进入正极区,故cd为阴离子交换膜,在阳极,溶液中的OH-放电,溶液呈酸性,得到H2SO4溶液.
(A)通电后中间隔室的SO42-向正极迁移,正极反应为:2H2O-4e-=O2 +4H+ 正极区溶液pH减小,(A)错.
(B)中间隔室的Na+通过ab膜进入负极区,负极反应为:2H2O+2e-=H2 +2OH-负极区得到NaOH溶液;SO42-通过cd膜进入正极区,正极反应为:2H2O-4e-=O2+4H+ 正极区得到H2SO4溶液,(B)正确.
(C)负极反应为: 2H2O+2e-=H2 +2OH-负极区溶液pH增大.(C)错误.
(D)由电子守恒:4n(O2)=1 mol,n(O2)= 0.25mol,(D)错误.
答案:(B)
例4(2014年全国卷I节选)H3PO2可以通过电解的方法制备.工作原理如图4所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
(1)写出阳极的电极反应式:
(2)分析产品室中可得到H3PO2的原因:
分析:(1)阳极室电解质溶液为硫酸溶液,阴离子有SO42-、OH-,OH-在阳极放电;阴极室电解质溶液为氢氧化钠溶液,阳离子有Na+、H+,H+在阴极放电.
(2)在电解池中,溶液中阳离子向阴极移动,阴离子向阳极移动.故阳极室中阳离子H+通过阳膜进入产品室,原料室中的阴离子H2PO2-通过阴膜进入产品室,阳离子Na+通过阳膜进入阴极室,在产品室H+与H2PO2-反应生成H3PO2.
答案:(1)2H2O-4e-=4H++O2
(2)阳极室的H+通过阳膜扩散至产品室,原料室中的H2PO2-通过阴膜扩散至产品室,二者反应生成H3PO2.
技巧提醒:
(1)在电解池中,各池中的阳离子向阴极移动,阴离子向阳极移动.
(2)各池中的阳离子只能透过阳膜向阴极移动而不能向阳极移动;各池中的阴离子只能透过阴膜向阳极移动而不能向阴极移动.
(3)若某室中同时有阴、阳离子进入,二者结合的产物即为该室产品;若某室中同时有阴、阳离子移出(或消耗),则二者结合的产物即为该室消耗的物质; 若某室中既有离子进入,又有离子移出(或消耗),进入离子与原溶液中未移出(或消耗)的离子结合的产物即为该室产品.
(4)在同一电解池或串联的各个电解池中,相同时间内,通过各离子交换膜的离子所带电量与通过外电路的电子所带电量相等.
(5)在电解池中,阳离子移向的方向为阴极,通过的交换膜为阳膜;阴离子移向的方向为阳极,通过的交换膜为阴膜.
(6)若离子交换膜为单质子交换膜,一般阳极反应要生成H+,阴极反应要消耗H+.
电化学相关知识是中学生应该掌握的必备知识,离子交换膜在电化学装置中的应用是近年高考的热点题型,有效突破电化学问题是取得优异化学成绩的重要保证.但无论是原电池还是电解池,只要能正确判断电极性质、离子移动方向和离子交换膜的类型就可以使相关问题迎刃而解.

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。电化学原理是普通高中化学选择性必修1化学反应原理中的重要组成部分,也是高考化学中...
一、判断有机物得失电子 例1: 微生物电池是指在微生物的作用下将化学能转化为电能的...
近几年全国卷高考电化学装置一般都带有离子交换膜,此类题目新颖度高,学生因理不清交...
【 知识归纳 】 1. 浓差电池的定义 物质由 高浓度 向 低浓度 扩散而引发的一类电池称...
锌溴液流电池是一种大规模储能电池,相比传统铅酸电池锂离子电池等,把电解质存放在容...
11111...