
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
现行高中化学教材对电解原理在工业上的应用 主要介绍了四点:①精炼金属,如铜的精炼;②电 镀,即在某些金属表面镀上一薄层其他金属或合金 的过程;③氯碱工业,即电解饱和食盐水以制得烧 碱、氢气、氯气;④电解熔融电解质,冶炼活泼金 属,如K、Ca、Na、Mg、A1等活泼金属可通过电解 其熔融的氯化物或氧化物制得。电解原理还有没有 其他的应用?答案是肯定的!
1利用电解原理测定元素的相对原子质量
[例1]已知在pH=4~5的溶液中,Cu2+几乎不水 解,而Fe3+几乎水解完全。某实验小组的同学欲通 过电解CuSO4溶液,并根据电极上析出铜的质量及 产生气体的体积来测定铜的相对原子质量,其实验 流程如下图所示:
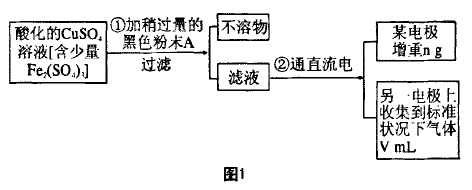
试回答实验中的下列问题:
(1)步骤①中所加人的A化学式为 ,加入A的作用是___________
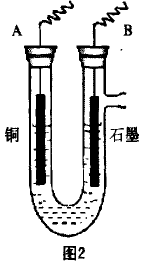
(2)步骤②中所用的部分仪器如下图2所示,则A接直流电源的 极(填“正”或“负”),电解的离子方程式为_________ 。
(3)实验中下列操作或注意事项必须的是_____ (填序号)。
A.称量电解前的电极的质量
B.电解后,电极在烘干称量前,必须用蒸馏水冲洗
C.刮下电解后电极上析出的铜,并清洗,称量
D.电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行
E.在有空气存在的情况下, 烘干电极必须用低温烘干的方法
(4)根据实验获得的数据,铜的相对原子质量为 (用题中所给数据表示)。
[解析]
(1)因为“在pH=4~5的环境中,Cu2+几乎 不水解,而Fe3+几乎水解完全”,所以加入CuO可消耗H+,使溶液的pH升高,Fe3+几乎完全水解成 Fe(OH)3而被除去。
(2)电解CuSO4溶液的总反应式 为:2CuSO4+2H2O 2Cu+O2+2H2SO4,则铜电 极应作电解池的阴极,与电源的负极相连。
2Cu+O2+2H2SO4,则铜电 极应作电解池的阴极,与电源的负极相连。
(3)A电 极的增重必须是净增Cu的质量;用蒸馏水冲洗电 极,目的是除去电极上的杂质,使A电极增重的质 量更准确;不能采取刮下电解后电极上的Cu的方 法,因为这样会造成误差;为了减小误差,往往采 取多次称量操作的方法;烘干电极必须采用低温烘 干法,是为了防止Cu在高温下与O2反应生成CuO。 综上分析知A、B、D、E正确。
(4)根据题意,“某电极 增重n g”,应为Cu的质量,“另一电极产生气体V mL"应为O2的体积。再根据CuSO4溶液电解的总反应式可解得铜的相对原子质量。
[答案](l)CuO消耗H+,使溶液的pH升高, Fe3+几乎完全水解成Fe (OH)3而被除去;
(2)负 2Cu2++2H2O 2Cu+O2 +4H+;
2Cu+O2 +4H+;
(3)A、B、D、E ;
(4) 11200 n/V
2利用电解原理测定阿伏加德罗常数
[例2]如图3是可用于测量阿伏加德罗常数的 装置示意图,其中A、B是两 块纯铜片,插在CuSO4稀溶液 中,铜片与引出导线相连,引出端分别为X、Y。
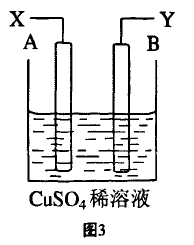
(1)当以I安培的电流电 解T秒钟后,测得铜片A的质量增加了m g,则装置图中的X端应与直流电的__极相连,它是电解池的__ 极。
(2)电解后铜片B的质量 (填“增加” “减少”或“不变”)。
(3)列式计算实验测得的阿伏加德罗常数NA= (已知电子电量e=1.60×10-19库仑)。
[解析]
(1)因为铜片A的质量增加,则A应为 电解池的阴极,与电源的负极相连。
(2)铜片B为电解池的阳极,电极反应式为:Cu-2e-=Cu2+, 铜片溶解,而使其质量在减少。
(3)转移电子的物 质的量为(m/64)×2 mol,通过电极的电量为(m/64)×2×NA×1.6×10-19,根据电量守恒可建立如下等量关系: Q= (m/64) ×2×NA×1.6×10-19=IT,从而得NA的表达式。
[答案】(1)负阴;(2)减少;(3)64 IT/(2×1.6×10-19m)
3利用电解原理制备消毒液
[例3]某一学生想制作一种家用环保型消毒液 发生器,用石墨作电极电解饱和NaCl溶液,通电 时,为使Cl2被完全吸收制得有较强杀 菌能力的消毒液,设计了如图4所示装置,试写出电源电极的名称,A______ ,B_____ (填“正极”或“负极”)。
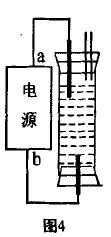
[解析]电解饱和食盐水阳极产生 Cl2、阴极产生H2,同时阴极区还产生 NaOH,要使阳极产生的Cl2与NaOH溶液完全反应生成有消毒杀菌的NaClO,则要求Cl2在 装置的下端产生,故b应是电源的正极,A就为电源 的负极。
[答案]负极正极
4利用电解原理制备易氧化的物质
[例4]由于Fe (0H)2极易被氧 化,所以实验室难用亚铁盐溶液与 烧碱反应制得白色纯净的Fe(OH)2 沉淀。若用如图5所示实验装置可制得纯净的Fe(OH)2沉淀。两极材 料分别为石墨和铁。
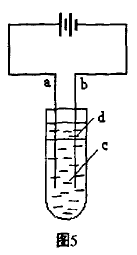
(1) a电极材料为_______ 其电极反应式为____________ 。
(2)电解液D可以是 ,则白色沉淀在电极上生成。也可以是 色沉淀在两极之间的溶液中生成。
A. NaCl溶液 B. NaOH溶液 C. CuCl2溶液
(3)液体C为苯,其作用是 ;在加入苯之前,对D溶液进行加热处理的目的是__________ 。
(4)为了在短时间内看到白色沉淀,可以采取 的措施是( )
A. 改用稀硫酸做电解液
B. 适当增大电源电压
C. 适当增大两电极间距离
D. 适当降低电解液温度
[解析](1)为获得Fe2+,Fe应与电源的正极相连 作阳极。(2)若用NaOH溶液作电解液,则Fe2+立即与 OH-结合,在阳极上生成白色沉淀;若用NaCl溶液 作电解液,则阴极生成的OH-向阳极移动,与在阳 极生成向阴极移动的Fe2+结合为白色沉淀。(3)由于 Fe(OH)2极易被空气中的O2所氧化,因此为了防止此反应发生,在电解液上面覆盖一层苯以隔绝空 气。在加苯前,将溶液煮沸,也是为了驱赶溶解在 水中的O2。(4)电解的速率与电压成正比,与两极间 距离成反比。若加稀H2SO4则沉淀溶解,若降低温度 则离子移动速率减慢,不利于沉淀生成。
[答案](l)Fe Fe-2e-=Fe2+; (2)BC; (3)隔绝 空气防止Fe(OH)2被空气氧化排尽溶液中的O2,防 止生成的Fe(OH)2在溶液中被氧化;(4)B
5利用电解原理在金属表面形成氧化物保护膜
[例5]以铝件和另一种材料为电极,某种溶液 为电解液进行电解。通电后在铝件与电解液的接触 面上逐渐形成一层A1 (OH)3薄膜,薄膜的某些部位 存在着小孔,电流从小孔通过并产生热量使Al(OH)3 分解,从而在铝件表面可形成一层较厚的氧化物保 护膜。某校课外兴趣小组根据上述原理,以铝件和 铁棒为电极,一定浓度的NaHCO3溶液为电解液进 行实验。
(1) 铝件表面形成Al (OH)3的电极反应式为
(2)电解过程中,必须使电解液pH保持相对稳定(不能太大,也不能太小)的原因是 。
[解析](1)以铝件和铁棒为电极,NaHCO3溶液 为电解液进行电解,则铝件应为电解池的阴极,相关 的电极反应为Al-3e-=Al3+、Al3++3HCO3- =Al(0H)3 + 3CO2。(2)需考虑Al2O3和Al(OH)3的两性。
[答案]⑴Al-3e-=Al3+、Al3++3HCO3- =Al(OH)3 +3CO2 ; (2)Al2O3和Al(OH)3为两性物质,电解液的酸性或碱性过强,都会使所形成的Al2O3保护 膜溶解。
6利用电解原理进行有机合成
[例6]以电化学方法合成有机化合物称为有机 电合成。有机电合成是一门有机化学、电化学和化 学工程多学科相互交叉的科学,是电化学在有机化 工生产中的重要应用。因而有机电合成又被称为 “古老的方法,崭新的技术”。人类对有机电合成的 研究已经经历了 150多年的漫长历史。早在1834年, 亭国化学家Faraday就用电解CH3COONa溶液的方法 -得了乙烷:2CH3COO--2e-=CH3CH3+2CO2 ,可 以说这是在实验室中最早实现的有机电合成。则该反应发生于________ (填“电解池”或“原电池”)的_____ 极。
[解析]用电解的方法制乙烷,CH3COO-失去电 子,因此该反应发生于电解池的阳极。
[答案]电解池阳
7利用电解原理进行污水处理
[例7]电浮选凝聚法是工 业上采用的一种污水处理方 法。如图6是该方法处理污水 的实验装置示意图,实验过程中,污水的pH始终保持在5.0~6.0之间。接通电源后,阴极产 生的气体将污物带到水面形成 浮渣而刮去,起到浮选净化作用;阳极产生的沉淀 具有吸附性,吸附污物而沉积,起到凝聚净化作用。
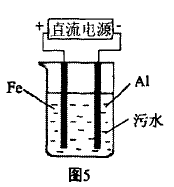
(1) 根据净化原理写出阳极区和阴极区发生的电极反应式,阴极 ,阳极 _。
(2) 甲同学模拟该原理进行污水处理实验,在 电压符合要求的情况下,发现产生气泡速率缓慢,无法使悬浮物形成浮渣。其原因是_________ ,乙同学为甲同学提出一种切实可行的解决措施是向污 水中加入适量的 溶液。
[解析](1)本实验从两个方面达到净水的目的: 第一是浮选,即阴极生成的H2气泡将污水中的悬浮 物带到水的表面,在水面上形成浮渣层,从而达到 净化污水的目的。第二是电凝聚,即在阳极上电极 发生氧化反应:Fe-2e-=Fe2+,水中负二价氧也发生 氧化反应:2H2O-4e-=4H++O2 ,Fe2+进一步被氧化:Fe2++10H2O+O2=4Fe(OH)3+8H+,由于生成的 Fe(OH)3具有吸附性,可将水中的污染物小颗粒吸附 而沉积下来,从而达到净化污水的目的。
(2)如果 污水中离子的浓度变小,则溶液的导电性必将变 差,所以向溶液中补充适量的Na2SO4溶液,可使电 解时产生札的速率加快。
[答案](1)阴极:2H++2e-=H2;阳极:①Fe-2e-= Fe2+;② 2H2O-4E =4H++O2 ;③4Fe2++10H2O+O2= 4Fe(OH)3+8H+; (2)污水中离子浓度较小,导电能 力较差;Na2SO4

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
锌溴液流电池是一种大规模储能电池,相比传统铅酸电池锂离子...
电化学是高中化学的重要组成部分,是高考的必考内容,然而,...
电化学原理是普通高中化学选择性必修1化学反应原理中的重要...
一、判断有机物得失电子 例1: 微生物电池是指在微生物的作用...
近几年全国卷高考电化学装置一般都带有离子交换膜,此类题目...
【 知识归纳 】 1. 浓差电池的定义 物质由 高浓度 向 低浓度 扩...