
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
有机物的物理性质与化学性质同等重要,且“结构决定性质,性质反映结构”不仅表现在化学性质中,同时也体现在某些物理性质上。有机物一些物理性质存在着内在规律,如果抓住其中的规律,可以更好地认识有机物。
一、熔沸点
有机物微粒间的作用是分子间作用力,分子间的作用力比较小,因此烃的熔沸点比较低。对于同系物,随着相对分子质量的增加,分子间作用力增大,因此同系物的熔沸点随着相对分子质量的增大而升高。
1. 烃、卤代烃及醛
各种烃的同系物、卤代烃及醛的熔沸点随着分子中碳原子数的增加而升高。如:![]() 、
、![]() 都是烷烃,熔沸点的高低顺序为:
都是烷烃,熔沸点的高低顺序为:![]() ;
;![]() 都是烯烃,熔沸点的高低顺序为:
都是烯烃,熔沸点的高低顺序为:![]() ;再有
;再有![]() ,
,![]() 等。
等。
同类型的同分异构体之间,主链上碳原子数目越多,烃的熔沸点越高;支链数目越多,空间位置越对称,熔沸点越低。如![]() 。
。
2. 醇
由于分子中含有—OH,醇分子之间存在氢键,分子间的作用力较一般的分子间作用力强,因此与相对分子质量相近的烃比较,醇的熔沸点高的多,如![]() 的沸点为78℃,
的沸点为78℃,![]() 的沸点为-42℃,
的沸点为-42℃,![]() 的沸点为-48℃。
的沸点为-48℃。
影响醇的沸点的因素有:
(1)分子中—OH个数的多少:—OH个数越多,沸点越高。如乙醇的沸点为78℃,乙二醇的沸点为179℃。
(2)分子中碳原子个数的多少:碳原子数越多,沸点越高。如甲醇的沸点为65℃,乙醇的沸点为78℃。
3. 羧酸
羧酸分子中含有—COOH,分子之间存在氢键,不仅羧酸分子间羟基氧和羟基氢之间存在氢键,而且羧酸分子间羰基氧和羟基氢之间也存在氢键,因此羧酸分子之间形成氢键的机会比相对分子质量相近的醇多,因此羧酸的沸点比相对分子质量相近的醇的沸点高,如1-丙醇的沸点为97.4℃,乙酸的沸点为118℃。
影响羧酸的沸点的因素有:
(1)分子中羧基的个数:羧基的个数越多,羧酸的沸点越高;
(2)分子中碳原子的个数:碳原子的个数越多,羧酸的沸点越高。
二、状态
物质的状态与熔沸点密切相关,都决定于分子间作用力的大小。
由于有机物大都为大分子(相对无机物来说),所以有机物分子间引力较大,因此一般情况下呈液态和固态,只有少部分小分子的有机物呈气态。
1. 随着分子中碳原子数的增多,烃由气态经液态到固态。分子中含有1~4个碳原子的烃一般为气态,5~16个碳原子的烃一般为液态,17个以上的为固态。如通常状况下![]() 、
、![]() 呈气态,苯及苯的同系物一般呈液态,大多数呈固态。
呈气态,苯及苯的同系物一般呈液态,大多数呈固态。
2. 醇类、羧酸类物质中由于含有—OH,分子之间存在氢键,所以醇类、羧酸类物质分子中碳原子较少的,在通常状况下呈液态,分子中碳原子较多的呈固态,如:甲醇、乙醇、甲酸和乙酸等呈液态。
3. 醛类
通常状况下除碳原子数较少的甲醛呈气态、乙醛等几种醛呈液态外,相对分子质量大于100的醛一般呈固态。
4. 酯类
通常状况下一般分子中碳原子数较少的酯呈液态,其余都呈固态。
5. 苯酚及其同系物
由于含有—OH,且苯环相对分子质量较大,故通常状况下此类物质呈固态。
三、密度
烃的密度一般随碳原子数的增多而增大;一氯代烷的相对密度随着碳原子数的增加而减小。
注意:
1. 通常气态有机物的密度与空气相比,相对分子质量大于29的,比空气的密度大。
2. 通常液态有机物与水相比:
(1)密度比水小的有烃、酯、一氯代烃、一元醇、醛、酮、高级脂肪酸等;
(2)密度比水大的有溴代烃、硝基苯、四氯化碳、氯仿、乙二醇、丙三醇等。
四、溶解性
研究有机物的溶解性时,常将有机物分子的基团分为憎水基和亲水基:具有不溶于水的性质或对水无吸引力的基团,称为憎水基团;具有溶于水的性质或对水有吸引力的基团,称为亲水基团。有机物的溶解性由分子中亲水基团和憎水基团的溶解性决定。
1. 官能团的溶解性
(1)易溶于水的基团(即亲水基团)有:—OH、—CHO、—COOH、—NH2。
(2)难溶于水的基团(即憎水基团)有:所有的烃基(如—![]() 、—CH=CH2、—C6H5等)、卤原子(—X)、硝基(—NO2)等。
、—CH=CH2、—C6H5等)、卤原子(—X)、硝基(—NO2)等。
2. 分子中亲水基团与憎水基团的比例影响物质的溶解性
(1)当官能团的个数相同时,随着烃基(憎水基团)碳原子数目的增大,溶解性逐渐降低,如溶解性:![]() >(一般地,碳原子个数大于5的醇难溶于水);再如,分子中碳原子数在4以下的羧酸与水互溶,随着分子中碳链的增长,在水中的溶解度迅速减小,直至与相对分子质量相近的烷烃的溶解度相近。
>(一般地,碳原子个数大于5的醇难溶于水);再如,分子中碳原子数在4以下的羧酸与水互溶,随着分子中碳链的增长,在水中的溶解度迅速减小,直至与相对分子质量相近的烷烃的溶解度相近。
(2)当烃基中碳原子数相同时,亲水基团的个数越多,物质的溶解性越强。如溶解性: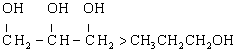 。
。
(3)当亲水基团与憎水基团对溶解性的影响大致相同时,物质微溶于水。例如,常见的微溶于水的物质有:苯酚![]() 、苯胺
、苯胺![]() 、苯甲酸
、苯甲酸![]() 、正戊醇
、正戊醇![]()
![]() (上述物质的结构简式中“-”左边的为憎水基团,右边的为亲水基团)。
(上述物质的结构简式中“-”左边的为憎水基团,右边的为亲水基团)。
(4)由两种憎水基团组成的物质,一定难溶于水。例如,卤代烃R—X、硝基化合物R—![]() 均为憎水基团,故均难溶于水。
均为憎水基团,故均难溶于水。
3. 有机物在汽油、苯、四氯化碳等有机溶剂中的溶解性与在水中相反。如乙醇是由较小憎水基团![]() 和亲水基团—OH构成,所以乙醇易溶于水,同时因含有憎水基团,所以也必定溶于四氯化碳等有机溶剂中。其他醇类物质由于都含有亲水基团—OH,小分子都溶于水,但在水中的溶解度随着憎水基团的不断增大而逐渐减小,在四氯化碳等有机溶剂中的溶解度则逐渐增大。
和亲水基团—OH构成,所以乙醇易溶于水,同时因含有憎水基团,所以也必定溶于四氯化碳等有机溶剂中。其他醇类物质由于都含有亲水基团—OH,小分子都溶于水,但在水中的溶解度随着憎水基团的不断增大而逐渐减小,在四氯化碳等有机溶剂中的溶解度则逐渐增大。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
醇酚醚醛酮都含有电负性大的氧原子,其水溶性却有不同,分别...
一、鉴别原则 (1)一般选择能产生“有色沉淀、颜色变化、气体”...
一、单烯烃及单炔烃 1.命名步骤 1)选主链 将含有碳碳双键或碳...
一、 甲烷 1、状态: 烷烃常温下存在的状态由气态逐渐过渡到液...
近几年的髙考有机化学试题中,经常出现消耗 NaOH、H2、Br2、Na、...
一、等效氢法 要点:①同—C上的H是等效的;②同—C上所连的—...