
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
高中化学课本主要内容是:以ZnCl2为电镀液,在铁制品上镀一层锌.学生在学习这部分内容时常常提问:在阴极,为什么Zn2+比H+容易获得电子?课本指出:在电镀所控制的条件下,电镀液中H+一般不起反应.由于受中学教材的限制,课本对电镀所控制的条件究竟是什么以及为什么H+一般不起反应没有深入、具体地说明.现就此问题进行探讨,以求明确,供教学参考.
中学生常常根据金属活动性顺序判断阳离子得电子的顺序.事实上,阳离子得电子顺序,不仅仅由金属活动性决定,同时还受离子浓度、电流密度和电极材料等因素的影响.
一、离子浓度的影响
金属活动性顺序是在标准状态(25℃,1.013×105Pa,金属离子浓度为1mol·L-1)时,金属在水溶液中失去电子生成简单离子的能力大小的顺序.可是在通常情况下,电镀并不都是按标准状态进行的.上述电镀液最简单的配方,是在20~30%ZnCl2溶液加几滴盐酸(防止ZnCl2水解).若实验时使用25%的ZnCl2电镀液,控制其pH=5.5,经计算得[Zn2+]=2.24mol·L-1,[H+]=3.16×10-6mol·L-1.有关标准电极电位如
![]()
![]()
当p(H2)=1.013×105Pa时
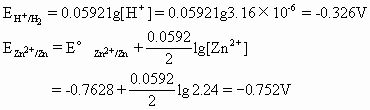
![]()
![]()
不能说明Zn2+比H+容易获得电子这一实验事实.
二、电流密度和电极材料的影响
在电解过程中,由于电流的通过,阴、阳两极的电极电位发生了某种改变,这种现象叫做极化.极化使阴极和阳极产生了超电势,超电势跟电流密度、电极材料、温度以及析出物质的性质、状态等多种因素有关.一般说来,析出金属的超电势较小,而析出气体(特别是氢、氧)的超电势较大.常温下进行上述电镀实验时,一般控制电流密度不超过100~200A·m-2.若电流密度控制为100A·m-2,则氢在作为阴极的铁镀件表面析出时的超电势为0.56V,此时:
![]()
当在铁表面镀上一层锌后,析出氢的超电势更大,为0.75V,则
![]()
而锌在阴极析出的超电势很小,可忽略不计,因此,
![]()
![]()
综上所述,在考虑了离子浓度、电流密度和电极材料等因素的影响后,课本中指出的电镀所控制的条件就清楚了,此时自然就得出Zn2+比H+容易获得电子的结论.
需要指出的是:若电镀条件控制不当,如外加电压过高、电镀液浓度较小以及酸度太大等,则H+获得电子的能力就会接近甚至大于Zn2+,显然,这对电镀锌是不利的.

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
在原电池工作原理中,我们知道电极电势差是电子定向移动的驱...
电解熔融AlO时加入冰晶石(NaAlF)能降低其熔化温度,主要原理...
什么是电极的极化? 在工作中,我常常会被一些非专业领域的朋...
先看高考题: 2006年全国高考第9题已明确说明熔融状态下氯化铝...
锂电池是20世纪开发成功的新型高能电池,可以理解为含有锂元...
现行高级中学教科书化学第三册 (选修)中的镀锌实验:以铁片...