
|
学习小专题 |
 酸式盐相关性质总结
日期:2021-05-21 10:49:28
点击:4125
好评:0
酸式盐相关性质总结
日期:2021-05-21 10:49:28
点击:4125
好评:0
在离子反应这一部分,高中化学与初中化学最大的区别莫过于酸式盐的大量出现。酸式盐的性质多样,反应时关系复杂,是化学推断题中非常青睐的考点。下面便对酸式盐做一个简要的总结。 I. 基本概念 酸式盐是弱酸中的氢离子部分被碱中和的产物,其中含有酸式酸根离子。酸式盐在...
 如何定量判断弱酸酸式盐溶液酸碱性
日期:2021-03-05 16:22:04
点击:2377
好评:0
如何定量判断弱酸酸式盐溶液酸碱性
日期:2021-03-05 16:22:04
点击:2377
好评:0
例3 常温下,0.1mol·L -1 NaHSO 3 溶液呈 (填“酸性”“中性”或“碱性”)? 分析:HS O 3 - +H 2 O H 2 SO 3 +OH - 使溶液呈碱性 HS O 3 - S O 3 2 - +H + 使溶液呈酸性 溶液的酸碱性取决于水解占主要的,还是电离占主要的. 如何判断两个反应谁是主要的呢? ...
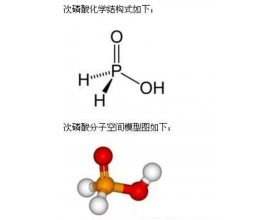 搞定酸式盐,你还有什么盐可担心的!
日期:2020-12-22 08:57:49
点击:1128
好评:0
搞定酸式盐,你还有什么盐可担心的!
日期:2020-12-22 08:57:49
点击:1128
好评:0
一、溶解性 绝大多数的酸式盐易溶于水,而且酸式盐的溶解度大于正盐。如Ca(HCO 3 ) 2 >CaCO 3 ,Mg(HCO 3 ) 2 >MgCO 3 ,但NaHCO 3 的溶解性小于Na 2 CO 3 二、电离及溶液的酸碱性 绝大多数的酸式盐由多元弱酸形成,但也有由多元强酸形成酸式盐。如NaHSO 4 。 1、电离 (1)...
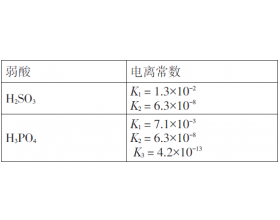 定量分析弱酸酸式盐溶液酸碱性问题
日期:2019-10-30 15:09:24
点击:1228
好评:1
定量分析弱酸酸式盐溶液酸碱性问题
日期:2019-10-30 15:09:24
点击:1228
好评:1
表2 几种弱酸的电离常数(25 ℃) 例3 常温下,0.1mol·L -1 NaHSO 3 溶液呈( )(填“酸性”“中性”或“碱性”)? 分析: HS O 3 - +H 2 O H 2 SO 3 +OH - 使溶液呈碱性 HS O 3 - S O 3 2 - +H + 使溶液呈酸性 溶液的酸碱性取决于水解占主要的,还是电离占主要...
 酸式盐在化学反应中的规律
日期:2016-04-24 22:12:00
点击:5886
好评:0
酸式盐在化学反应中的规律
日期:2016-04-24 22:12:00
点击:5886
好评:0
在高中化学教学中,常遇到酸式盐参加的化学反应,而教材中没有系统编排这部分内容,所以 学生在运用这部分知识时感到棘手。现根据多年的教学实践,将酸式盐的反应规律总结如下: 一、酸式盐与酸的反应 1. 酸式盐与无强氧化性酸的作用 参加反应的酸比形成酸式盐的酸酸性...
 酸式盐性质种种
日期:2015-09-28 10:09:19
点击:8265
好评:0
酸式盐性质种种
日期:2015-09-28 10:09:19
点击:8265
好评:0
中学阶段涉及到有关酸式盐的内容较多,而且较为分散。为了便于掌握,本文对其进行归纳总结以供参考。 一、溶解性 绝大多数的酸式盐易溶于水,而且酸式盐的溶解度大于正盐。如 Ca(HCO 3 ) 2 > CaCO 3 , Mg(HCO 3 ) 2 > MgCO 3 ,但 NaHCO 3 的溶解性小于 Na 2 CO 3...
 酸式盐的水解与电离比较
日期:2015-02-01 15:28:41
点击:7978
好评:0
酸式盐的水解与电离比较
日期:2015-02-01 15:28:41
点击:7978
好评:0
盐类的水解中,什么时候水解大于电离,什么时候电离大于水解?高中都需要掌握那些盐? 1. 常见的电离大于水解的酸式盐有:亚硫酸氢盐,磷酸二氢盐,草酸氢盐等大多数酸式盐(溶液呈酸性)。 2.常见的水解大于电离的酸式盐有:磷酸一氢盐,碳酸氢盐,硫氢化物等少数酸式盐(...
 关于酸式盐的几个问题集
日期:2012-10-11 15:56:46
点击:9382
好评:0
关于酸式盐的几个问题集
日期:2012-10-11 15:56:46
点击:9382
好评:0
中学化学中接触到的酸式盐的数量不多,学生对酸式盐性质认识较为肤浅,因此在考试中比较容易失分。而酸式盐是高考考试的考点之一,本文着重谈谈酸式盐的几个重要问题。 酸式盐的溶解性 一般情况下酸式盐的溶解度大于相对应的正盐溶解度,但是碱金属元素中有例外,同条件下碳...
 酸式盐水溶液的酸碱性概括小结
日期:2012-05-16 09:43:40
点击:7967
好评:0
酸式盐水溶液的酸碱性概括小结
日期:2012-05-16 09:43:40
点击:7967
好评:0
(1)强碱强酸酸式盐 由于在水溶液中只能进一步电离出H + ,不会发生水解,所以只具备酸性,可代替一元强酸使用,如: NaHSO 4 +NaHCO 3 =Na 2 SO 4 +H 2 O+CO 2 ↑ NaHSO 4 +NaCl Na 2 SO 4 +HCl↑ (2)强碱弱酸酸式盐 由于强碱弱酸酸式盐中含有弱酸酸式根,既可以进一步...
 酸式盐的成因
日期:2006-10-26 05:07:19
点击:7494
好评:0
酸式盐的成因
日期:2006-10-26 05:07:19
点击:7494
好评:0
化学反应中,何时生成正盐,何时生成酸式盐。是同学们在化学学习时感到困惑的,下面我把酸式盐生成的几种情况简单介绍一下。 1. 反应条件不同,可生成正盐或酸式盐 微热 NaCl+H 2 SO 4 (浓)===== NaHSO 4 +HCl 强热 2NaCl + (浓)H 2 SO 4 ====Na 2 SO 4 +2HCl 微热 KN...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。