
|
学习小专题 |

|
学习小专题 |
 [元素化合物] 元素拓展:铬及其化合物总结 作者:化学自习室 来源:未知 日期:2023-10-07 14:28:06 点击:1085 所属专题:铬及其化合物
[元素化合物] 元素拓展:铬及其化合物总结 作者:化学自习室 来源:未知 日期:2023-10-07 14:28:06 点击:1085 所属专题:铬及其化合物
一、铬 铬的物理性质 :银白色金属,由于单电子多,金属键强,故硬度及熔点均高,是硬度最高的过渡金属。由于铬的机械强度好,且有抗腐蚀性能,被用于钢铁合金中。不锈钢中含铬量最高,可达 20 %左右。许多金属表面镀铬,防锈,光亮 铬的存在和制取 ① 存在: 铬在自然...
 [元素化合物] 元素拓展:锰及其化合物总结 作者:化学自习室 来源:未知 日期:2023-10-07 11:21:59 点击:4851 所属专题:锰及其化合物
[元素化合物] 元素拓展:锰及其化合物总结 作者:化学自习室 来源:未知 日期:2023-10-07 11:21:59 点击:4851 所属专题:锰及其化合物
一、锰单质 块状锰是呈灰色,是一种较活泼的金属,在空气中金属锰的表面被一层褐色的氧化膜所覆盖,甚至与冷的浓硝酸也形成强的氧化膜,所以呈化学惰性。 二、锰的化合物的价态规律 稳定:Mn 2+ 、MnO 2 (不溶于酸的固体)、MnO 4 - 、Mn 2 O 3 (MnOOH(氢氧化氧锰)) ...
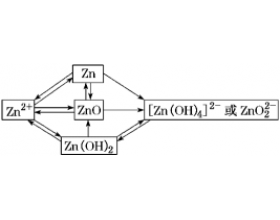 [元素化合物] 元素拓展:锌及其化合物总结 作者:化学自习室 来源:未知 日期:2023-10-07 11:19:04 点击:689 所属专题:锌及其化合物
[元素化合物] 元素拓展:锌及其化合物总结 作者:化学自习室 来源:未知 日期:2023-10-07 11:19:04 点击:689 所属专题:锌及其化合物
1.锌及其化合物“心连心” 2.金属锌的化学性质 (1)与空气中的水、CO 2 、O 2 反应: CO 2 +2O 2 +3H 2 O+4Zn===ZnCO 3 ·3Zn(OH) 2 (3)与酸、碱的反应:Zn+2HCl===ZnCl 2 +H 2 ↑, Zn+2H 2 O+2NaOH===Na 2 [Zn(OH) 4 ] + H 2 ↑ 或Zn+2NaOH===Na 2 ZnO 2 +...
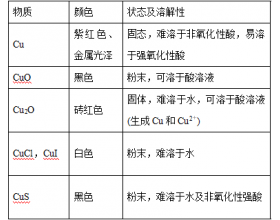 [元素化合物] 元素拓展:铜及其化合物总结 作者:化学自习室 来源:未知 日期:2023-10-07 10:55:30 点击:577 所属专题:铜及其化合物
[元素化合物] 元素拓展:铜及其化合物总结 作者:化学自习室 来源:未知 日期:2023-10-07 10:55:30 点击:577 所属专题:铜及其化合物
1 .“铜”的颜色与溶解性 2.铜被锈蚀 ( 1 ) 与 O 2 的反应 : 在空气中或 O 2 中加热表面变黑: 利用此反应可除去混在 H 2 、 CO 中的少量 O 2 。 ( 2 )与 O 2 、 CO 2 、 H 2 O 的作用 : 铜在干燥的空气中比较稳定,在水中也几乎不反应, 在 含有二氧化碳的 潮...
 [元素化合物] 常见的化学物质俗称大全 作者:化学自习室 来源:未知 日期:2023-09-13 16:13:21 点击:537 所属专题:俗名
[元素化合物] 常见的化学物质俗称大全 作者:化学自习室 来源:未知 日期:2023-09-13 16:13:21 点击:537 所属专题:俗名
...
 [元素化合物] 物质的用途及性质总结 作者:化学自习室 来源:未知 日期:2023-08-13 07:59:41 点击:670 所属专题:物质性质与用途
[元素化合物] 物质的用途及性质总结 作者:化学自习室 来源:未知 日期:2023-08-13 07:59:41 点击:670 所属专题:物质性质与用途
一、金属 1、钠 (1)K、Na合金可作核反应堆的传热介质,为唯一液态合金。 (2)Na燃烧不能用水灭,用干燥的沙土。Na、Mg的燃烧不用泡沫灭火剂灭火 (3)钠保存于煤油或石蜡里,金属锂只能存于石蜡中。钠的工业制备方法为电解熔融氯化钠。 (4)钠可用做电光源,制作高压钠灯。 ...
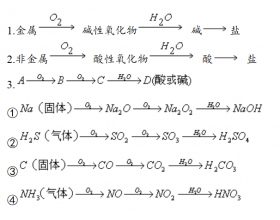 [元素化合物] 常考物质转化关系 作者:化学自习室 来源:未知 日期:2023-08-12 09:43:57 点击:596 所属专题:物质转化
[元素化合物] 常考物质转化关系 作者:化学自习室 来源:未知 日期:2023-08-12 09:43:57 点击:596 所属专题:物质转化
一、直线型转化 二、交叉型转化 三、三角形转化 四、元素及其化合物的转化关系 ( 注意向前走得通,倒退能否行 ) 1 、 Na → Na 2 O → Na 2 O 2 → NaOH → Na 2 CO 3 → NaHCO 3 → NaCl → Na Na → NaOH → CaCO 3 → CaCl 2 → CaCO 3 → CaO → Ca(OH) 2 → NaOH 2...
 [元素化合物] 常考物质的俗名 作者:化学自习室 来源:未知 日期:2023-08-12 09:40:39 点击:576 所属专题:俗名
[元素化合物] 常考物质的俗名 作者:化学自习室 来源:未知 日期:2023-08-12 09:40:39 点击:576 所属专题:俗名
一、常考无机物俗名 物质化学式 俗名 Hg 水银 Pt 白金 C 金刚石、石墨、(C 60 )足球烯、钻石 P 紫磷、红磷(赤磷)、黑磷(金属磷)、白磷(黄磷)(P 4 ) S 硫磺、硫黄 As 砒 Fe 2 O 3 铁锈、铁红、铁丹、红粉 Fe 3 O 4 磁性氧化铁、烤蓝 Al 2 O 3 蓝宝石、红宝石、刚玉 MgO ...
 [元素化合物] 常考物质的用途 作者:化学自习室 来源:未知 日期:2023-08-12 09:33:45 点击:271 所属专题:物质性质与用途
[元素化合物] 常考物质的用途 作者:化学自习室 来源:未知 日期:2023-08-12 09:33:45 点击:271 所属专题:物质性质与用途
一、常考无机物的用途 1.N 2 :合成氨,填充灯泡(与氩气),保存粮食。 2.稀有气体:保护气,霓虹灯,激光。 3.H 2 :探空气球,氢氧焰,冶金,合成氨,高能无害燃料。 4.CO 2 :灭火剂,制纯碱,制尿素,人工降雨(干冰)。 5.C:金刚石:制钻头;石墨:制电极,坩埚,铅笔芯...
 [元素化合物] 非金属及其化合物知识点总结 作者:化学自习室 来源:未知 日期:2023-12-18 09:10:26 点击:722 所属专题:非金属及其化合物
[元素化合物] 非金属及其化合物知识点总结 作者:化学自习室 来源:未知 日期:2023-12-18 09:10:26 点击:722 所属专题:非金属及其化合物
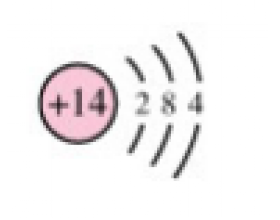
一、硅及其化合物 Si 硅元素在地壳中的含量排第二,在自然界中没有游离态的硅,只有以化合态存在的硅,常见的是二氧化硅、硅酸盐等。 硅的原子结构示意图为 ,硅元素位于元素周期表第三周期第ⅣA族,硅原子最外层有4个电子,既不易失去电子又不易得到电子,主要形成四价...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【导读】“强酸制弱酸”是复分解反应的常见规律,其本质是强酸电离出的H更易与弱酸根...
在高中化学中,很多同学从初中就学习了复分解反应, 都知道复分解反应中“强酸制弱酸...
1.水银:汞Hg 2.过氧一硫酸:过氧硫酸过硫酸 H 2 SO 5 3.白金:主要成分铂 Pt 4.苯:C...
...
元素种类 对应物质的常考易错点 N 性质:(1)浓HNO 3 和Cu(足量)在反应时,随反应进行...
例题1:浓硫酸与金属反应的条件 题目:常温下,浓硫酸能否与金属铁发生反应? 错误答...
鲍林在研究含氧酸时,将其化学式一般写作 HRO,其中 R 代表中心原子,羟基(–OH)与...
...