
|
学习小专题 |

|
学习小专题 |
 [方法与规律9] 硫及其化合物的一般与特殊 作者:王瑜 来源:未知 日期:2016-01-21 13:59:57 点击:11023 所属专题:硫及其化合物
[方法与规律9] 硫及其化合物的一般与特殊 作者:王瑜 来源:未知 日期:2016-01-21 13:59:57 点击:11023 所属专题:硫及其化合物
1.一般硫和金属反应不如氧容易,但硫与银、汞却在常温下反应,而氧不能。 2Ag+S==Ag 2 S;Hg+S==HgS。 2.加热铝粉和硫粉的混合物可生成Al 2 S 3 ,但不能通过溶液中的复分解反应制备Al 2 S 3 。因为2Al 3+ +3S 2 - +6H 2 O==2Al(OH) 3 ↓+3H 2 S↑。 3.单质硫与变...
 [方法与规律9] 铵盐分解规律 作者:袁建标 来源:未知 日期:2016-01-21 14:10:23 点击:6823 所属专题:铵盐
[方法与规律9] 铵盐分解规律 作者:袁建标 来源:未知 日期:2016-01-21 14:10:23 点击:6823 所属专题:铵盐
铵盐热稳定性差,受热均能分解 . 但请注意:未必有 NH 3 产生 . 这由盐中对应酸的稳定性、挥发性、氧化性等因素来决定 . ① 稳定易挥发酸成的铵盐 NH 3 +酸的挥发性物质 如 NH 4 Cl (s) ==NH 3 + HCl ② 稳定难挥发酸成的铵盐 如 (NH 4 ) 2 SO 4 == 2NH 3 + H 2 SO 4...
 [方法与规律9] 硫化物颜色、溶解性规律及应用 作者:程新 来源:未知 日期:2023-04-06 15:58:40 点击:32669 所属专题:硫化物 颜色 溶解性
[方法与规律9] 硫化物颜色、溶解性规律及应用 作者:程新 来源:未知 日期:2023-04-06 15:58:40 点击:32669 所属专题:硫化物 颜色 溶解性
一、硫化物 的颜色及溶解性规律: 硫化银 (Ag 2 S) :灰黑色,微溶于热水,溶于浓硫酸和 KCN 溶液。 三硫化二锑 (Sb 2 S 3 ) :黄红色,难溶于水,溶于酒精、 NH 4 HS 、 K 2 S 溶液和盐酸;不溶于醋酸。 硫化亚铁 (FeS) :黑棕色,难溶于水,溶于稀硫酸和盐酸 ( 起反应 ...
 [方法与规律9] 有关硝酸与金属反应的计算 作者:黄贞帧 来源:未知 日期:2016-01-21 12:28:39 点击:18181 所属专题:硝酸与金属
[方法与规律9] 有关硝酸与金属反应的计算 作者:黄贞帧 来源:未知 日期:2016-01-21 12:28:39 点击:18181 所属专题:硝酸与金属
硝酸与金属反应的计算是一个难点,本文从思维角度加以阐述,供大家参考。 一、从反应的本质看: 金属与硝酸反应的实质是金属与H + 和NO 3 - 共同作用. 例如:铜与稀硝酸反应的实质是:3Cu +8H + +2NO 3 - ===3Cu 2+ +4H 2 O +2NO Fe 2+ 与稀硝酸反应的实质是:3Fe 2+ + 4H + +...
 [方法与规律9] 发烟硫酸的破解 作者:王利平 来源: 日期:2016-01-21 12:49:17 点击:8327 所属专题:发烟硫酸
[方法与规律9] 发烟硫酸的破解 作者:王利平 来源: 日期:2016-01-21 12:49:17 点击:8327 所属专题:发烟硫酸
发烟硫酸的知识考察在各类试题中经常出现,大多数同学对发烟硫酸认识不清,百思不得其解。 发烟硫酸其实并不发烟,而是雾,是溶解在浓硫酸中的SO 3 挥发出来与空气中的水蒸气形成的细小雾珠,发烟硫酸中不含溶剂水,其组成可表示为:H 2 SO 4 ﹒ nSO 3 。 关于发烟硫酸...
 [方法与规律9] 热点物质:倍受青睐的“硫酸氢钠” 作者:王宗峰 来源: 日期:2020-03-05 18:52:12 点击:13968 所属专题:硫酸氢钠
[方法与规律9] 热点物质:倍受青睐的“硫酸氢钠” 作者:王宗峰 来源: 日期:2020-03-05 18:52:12 点击:13968 所属专题:硫酸氢钠
硫酸氢钠是我们中学阶段学习的一种重要的强酸酸式盐,以其完全电离的强酸性成为高考命题的重要物质载体。 一、硫酸氢钠的性质 1、完全电离,强酸性:NaHSO 4 ==Na + +H + +SO 4 2- 可以与弱酸盐发生复分解反应:NaHSO 4 +NaHSO 3 ==Na 2 SO 4 +SO 2 +H 2 O NaHSO 4 +Na...
 [方法与规律9] 被还原的酸占多少 作者:章文 来源: 日期:2016-01-21 13:05:05 点击:5804 所属专题:硝酸与金属
[方法与规律9] 被还原的酸占多少 作者:章文 来源: 日期:2016-01-21 13:05:05 点击:5804 所属专题:硝酸与金属
金属与一些氧化性酸反应的计算题,常出现在各类测试题中这类题目有规律可循。 例如,铁与稀硝酸的反应: Fe+4HNO 3 =Fe(NO 3 ) 3 +NO+2H 2 O (HNO 3 过量) 3Fe+8HNO 3 =3Fe(NO 3 ) 2 +2NO+4H 2 O (Fe过量) 以上两反应被还原的硝酸均占反应硝酸的1/4。 铁与浓HNO 3 加...
 [方法与规律9] 热点物质:硫代硫酸钠知识点探析 作者:雷海青 来源: 日期:2020-03-05 18:57:11 点击:39972 所属专题:硫代硫酸钠 热点物质
[方法与规律9] 热点物质:硫代硫酸钠知识点探析 作者:雷海青 来源: 日期:2020-03-05 18:57:11 点击:39972 所属专题:硫代硫酸钠 热点物质
硫代硫酸钠晶体( Na 2 S 2 O 3 5H 2 O )为无色透明的晶体,易溶于水,俗名为海波、大苏打。在化学教科书中虽然没有涉及到硫代硫酸钠的内容,但在高考中却多次出现。现把硫代硫酸钠的一些重要知识点归纳如下。 知识点 1 硫代硫酸钠的结构 硫代硫酸钠中的 S 2 O 3 2-...
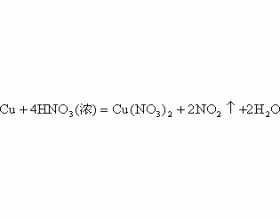 [方法与规律9] “硝酸+金属”反应的多角度剖析 作者:彭琳 来源: 日期:2016-01-21 12:04:09 点击:6595 所属专题:硝酸与金属
[方法与规律9] “硝酸+金属”反应的多角度剖析 作者:彭琳 来源: 日期:2016-01-21 12:04:09 点击:6595 所属专题:硝酸与金属
一、反应中硝酸由浓变稀 例 1. 向 100mL18mol/L 的浓 HNO 3 中加入足量的铜片,充分反应后,被还原的硝酸的物质的量是() A.0.9 mol B.0.45mol C. 大于 0.45mol 小于 0.9mol D. 无法确定 分析:铜片与浓、稀 HNO 3 发生反应的方程式为: 在反应过程中,浓硝酸逐渐变为...
 [方法与规律9] 磷酸与碱反应的产物判断技巧 作者:周四 来源: 日期:2016-01-21 11:23:55 点击:7140 所属专题:磷酸
[方法与规律9] 磷酸与碱反应的产物判断技巧 作者:周四 来源: 日期:2016-01-21 11:23:55 点击:7140 所属专题:磷酸
根据磷酸与碱的物质的量的不同关系.反应后的主要产物可能是三种盐之一,也可能是某两种盐的混合物或其它情况,如何简捷判断磷酸与碱反应后的结果呢?笔者在实践中得出如下快速判断技巧: xmol 碱 R(OH) m 和 ymol 磷酸 H 3 PO 4 发生反应,这里仅考虑反应 H + +OH - =...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
由于硝酸具有强氧化性,能与金属活动顺序表中除Pt、Au以外的所...
H 2 O、OH - 或其他含-2价O的化合物常常是氧化还原反应方程式...
[ 例 ] 现有 1L 含 SO 3 为 30% 的发烟硫酸(密度为 1.95g/cm 3 ),要...
一、硫化物 的颜色及溶解性规律: 硫化银 (Ag 2 S) :灰黑色,微溶...
例题 1、 在某100ml的混合液中,硝酸和硫酸的物质量浓度分别是...
铜与硝酸的反应体现了硝酸的强氧化性与酸性 , 浓硝酸在反应过...
例:将Mg、Cu组成的2.64克混合物投入适量稀硝酸中恰好反应,固体...
氮的氧化物有NO、NO 2 ,N 2 O 4 等,但只有NO 2 能直接与水发生反...