
|
学习小专题 |

|
学习小专题 |
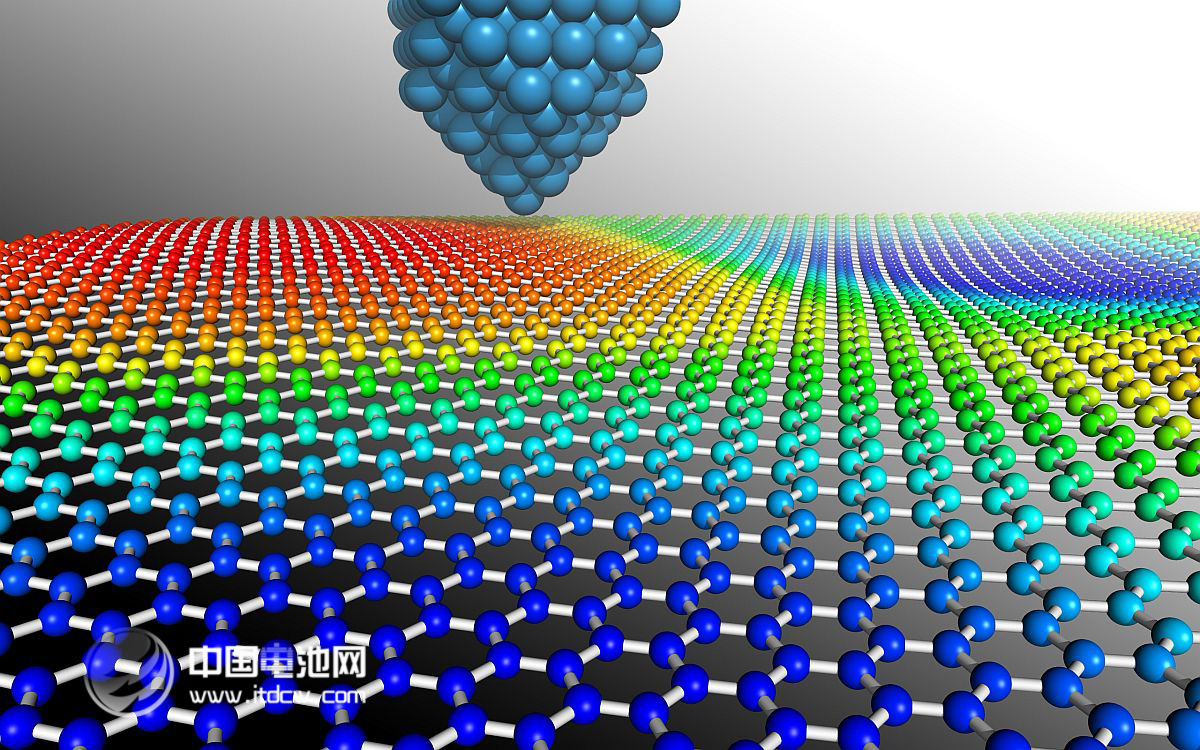 [注解与辨疑f] 形形色色的碳的同素异形体剖析 作者:化学自习室 来源:未知 日期:2020-10-26 11:25:29 点击:2618 所属专题:金刚石 石墨
[注解与辨疑f] 形形色色的碳的同素异形体剖析 作者:化学自习室 来源:未知 日期:2020-10-26 11:25:29 点击:2618 所属专题:金刚石 石墨
碳的单质及其晶体的性质比较复杂,在中学化学中主要涉及了四种类型,即原子晶体( 金刚石) 、分子晶体( 足球碳和炔碳) 和以石墨为代表的混合晶体,并且足球碳( 足球烯) 有关结构问题的计算也常有涉及。 一 、碳的同素异形体 1. 金刚石 基本结构正四面体的四个顶点及正中...
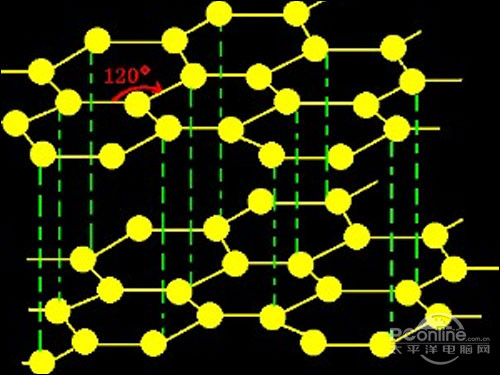 [注解与辨疑f] 浅析石墨的晶体类型 作者:化学自习室 来源:未知 日期:2020-10-16 08:51:57 点击:2087 所属专题:石墨
[注解与辨疑f] 浅析石墨的晶体类型 作者:化学自习室 来源:未知 日期:2020-10-16 08:51:57 点击:2087 所属专题:石墨
课程改革前,人教版高中《化学》教材上说:“像石墨这样的晶体一般称为过渡型晶体或混合型晶体。” 课程改革后,人教版高中《化学》教材选修3 (物质结 构与性质)上说:“石墨晶体中,既有共价键,又有金属键,还有范德华力,不能简单地归属于其中任何一种晶 体,是一种...
 [注解与辨疑f] 何谓晶胞的无隙并置 作者:化学自习室 来源:未知 日期:2020-08-02 08:34:15 点击:5731 所属专题:晶胞
[注解与辨疑f] 何谓晶胞的无隙并置 作者:化学自习室 来源:未知 日期:2020-08-02 08:34:15 点击:5731 所属专题:晶胞
固体分为晶体和非晶体,非晶体又 称为玻璃体。 微粒(原子、离子、分子)形成晶 体是为了使整个体系能量达到最低的结 果。微粒有序的按照一定的周期排列, 每个微粒所处的化学环境与物理环境均 相同,这样一来,在晶体中任意一个微 粒都处于受力的平衡状态,是最稳定的 ...
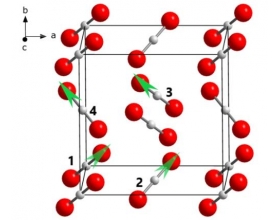 [注解与辨疑f] 干冰晶胞为什么不是面心立方晶胞? 作者:化学自习室 来源:未知 日期:2020-08-02 08:15:36 点击:5123 所属专题:干冰晶胞
[注解与辨疑f] 干冰晶胞为什么不是面心立方晶胞? 作者:化学自习室 来源:未知 日期:2020-08-02 08:15:36 点击:5123 所属专题:干冰晶胞
CO 2 分子显然是一个相比O 2 和I 2 来 说更为细长的直线型分子,因此在相 互堆积形成晶体时,仅仅像I 2 分子一样 在一个平面内转动已经不能满足其达到最密堆积的要求,而是在三维空间内发生了转动。事实上,晶胞中的CO 2 分子分别采取了4种不同的空间取向: 位于顶角的...
 [注解与辨疑f] 常见晶体的结构类型及分析 作者:化学自习室 来源:未知 日期:2020-06-11 18:05:24 点击:3325 所属专题:晶体结构模型
[注解与辨疑f] 常见晶体的结构类型及分析 作者:化学自习室 来源:未知 日期:2020-06-11 18:05:24 点击:3325 所属专题:晶体结构模型
晶体 晶体结构示意图 晶体中微粒分布详解 氯化钠晶体 Na + 和 Cl - 交替占据立方体的顶点而向空间延伸。在每个 Na + 周围最近的等距离 ( 设为 a) 的 Cl - 有 6 个 ( 上、下、左、右、前、后 ) ,在每个 Cl - 周围最近的等距离为 Na + 亦有 6 个,这 6 个离子构成...
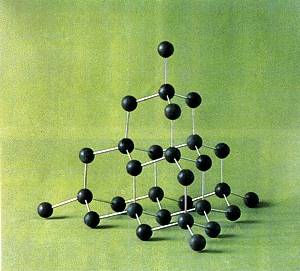 [注解与辨疑f] 动画演示:氯化钠晶胞、C60晶体结构 作者:化学自习室 来源:未知 日期:2020-03-10 15:48:53 点击:2490 所属专题:C60 石墨 氯化钠晶胞
[注解与辨疑f] 动画演示:氯化钠晶胞、C60晶体结构 作者:化学自习室 来源:未知 日期:2020-03-10 15:48:53 点击:2490 所属专题:C60 石墨 氯化钠晶胞
...
 [注解与辨疑f] 动画演示:六方最密堆积及面心立方最密堆积 作者:化学自习室 来源:未知 日期:2020-03-10 15:44:54 点击:4110 所属专题:六方最密堆积 面心立方最密堆积
[注解与辨疑f] 动画演示:六方最密堆积及面心立方最密堆积 作者:化学自习室 来源:未知 日期:2020-03-10 15:44:54 点击:4110 所属专题:六方最密堆积 面心立方最密堆积
...
 [注解与辨疑f] 晶格能和离子极化对离子化合物熔点的影响 作者:王文林 来源:未知 日期:2020-03-10 11:31:34 点击:1642 所属专题:晶格能 晶体熔点 离子键
[注解与辨疑f] 晶格能和离子极化对离子化合物熔点的影响 作者:王文林 来源:未知 日期:2020-03-10 11:31:34 点击:1642 所属专题:晶格能 晶体熔点 离子键
第一页 第二页...
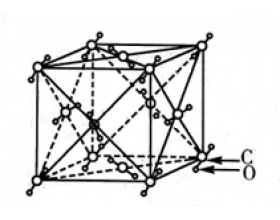 [注解与辨疑f] 常见分子晶体的结构特征 作者:化学自习室 来源:未知 日期:2020-01-03 10:35:16 点击:18463 所属专题:晶体结构模型
[注解与辨疑f] 常见分子晶体的结构特征 作者:化学自习室 来源:未知 日期:2020-01-03 10:35:16 点击:18463 所属专题:晶体结构模型
1.密堆积结构:分子间只有范德华力,不存在氢键。 若以一个分子为中心,其周围通常有12个紧邻的分子这种堆积特征称为分子密堆积,如C、干冰、I 2 、O 2 等。 图1表示的是CO 2 晶体晶胞的结构。由图可知,CO 2 晶体的晶胞是1个面心立方结构立方体的每个顶点上有1个CO 2 分子6...
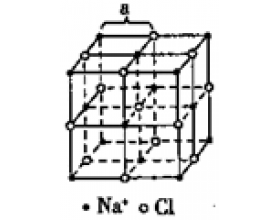
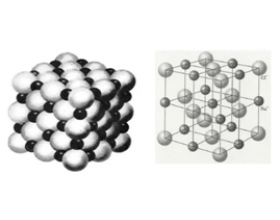 [注解与辨疑f] 常见的离子晶体结构介绍 作者:化学自习室 来源:未知 日期:2020-01-02 14:51:23 点击:24631 所属专题:离子晶体
[注解与辨疑f] 常见的离子晶体结构介绍 作者:化学自习室 来源:未知 日期:2020-01-02 14:51:23 点击:24631 所属专题:离子晶体
一、NaCl型(FCC点阵) FCC布拉维点阵在高中化学内理解为“面心立方结构” 1、Na + ,Cl - 交替排列,每一个离子周围都有个异类离子为最近,如果将两离子视为一类,则构成面心立方结构。 2、Cl - 构成面心立方点阵,Na + 占据全部八面体间隙,阳离子的配位数均为 3、每个...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
...
Na + 、Mg 2+ 、Al 3+ 的离子半径依次减小,电荷数依次增多,可是NaCl、MgCl 2 、A...
【导读】MgO熔点为2852℃;AlO熔点为2050–2054℃。 在对比中发现MgO中Mg半径比Al半径...
一、面心立方最密堆积 面心立方最密堆之中,八面体间隙位于 棱 心和体心,如上图可知...
1. Cu 、Fe交错 一种CuFeS 2 (黄铜矿)的 四方晶系 晶胞结构如图。 如果将该晶体中的...
在目前有些资料中,提及石墨中含有金属键。下面我们通过4种版本(人教版、鲁科版、苏...
金刚石硬度比石墨大得多,缘于金刚石的“均匀一体化”的空间网状结构,无论从哪个方向...