
|
学习小专题 |

|
学习小专题 |
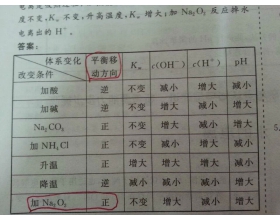 [注解与辨疑j] 过氧化钠为什么对水的电离促进? 作者:王世坤 来源:未知 日期:2015-01-28 09:10:32 点击:2065 所属专题:过氧化钠 水的电离
[注解与辨疑j] 过氧化钠为什么对水的电离促进? 作者:王世坤 来源:未知 日期:2015-01-28 09:10:32 点击:2065 所属专题:过氧化钠 水的电离
能消耗水中的氢离子或是氢氧根离子的反应都可以促进。过氧化钠其实是双氧水的正盐。而双氧水是弱酸。所以在本质上过氧化钠是强碱弱酸盐。要水解。水解在本质上就是促进水的电离。...
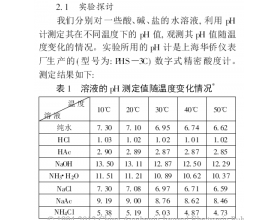 [注解与辨疑j] 温度越高,酸的pH越小,碱的pH越大吗? 作者:罗云峰 来源:未知 日期:2015-01-27 17:27:54 点击:2347 所属专题:水的电离
[注解与辨疑j] 温度越高,酸的pH越小,碱的pH越大吗? 作者:罗云峰 来源:未知 日期:2015-01-27 17:27:54 点击:2347 所属专题:水的电离
温度越高,酸的pH越小,碱的pH越大吗?很显然从图表得知不一定,因为不能单纯考虑酸碱盐的变化情况,还有考虑到水的电离情况的变化。...
 [注解与辨疑j] 恒温下向醋酸钠稀溶液中加入少量固体醋酸钠,醋酸根离子与钠离子 作者:吴乾环 来源:未知 日期:2025-07-29 15:57:16 点击:1264 所属专题:盐类水解
[注解与辨疑j] 恒温下向醋酸钠稀溶液中加入少量固体醋酸钠,醋酸根离子与钠离子 作者:吴乾环 来源:未知 日期:2025-07-29 15:57:16 点击:1264 所属专题:盐类水解
请教:恒温下向CH 3 COONa稀溶液中加入少量固体醋酸钠 c (CH 3 COO - )/ c (Na + )比值增大吗? 一般讲离子浓度比值的题都用极限法。比如这个题,开始醋酸根比钠离子比值是小于一的,后来加入醋酸钠固体,如果加了无限多的醋酸钠,这个体系就变成醋酸钠了。那么离子浓...
 [注解与辨疑j] 为什么计算只考虑氢氧化铁的溶解平衡,不考虑电离平衡? 作者:赵胜 来源:未知 日期:2015-01-27 15:21:56 点击:2579 所属专题:氢氧化铁 溶解平衡 电离平衡
[注解与辨疑j] 为什么计算只考虑氢氧化铁的溶解平衡,不考虑电离平衡? 作者:赵胜 来源:未知 日期:2015-01-27 15:21:56 点击:2579 所属专题:氢氧化铁 溶解平衡 电离平衡
氢氧化铁的溶液一般只考虑沉淀溶解平衡,而不去考虑弱电解质的电离平衡了,为啥?比如计算三价铁的量,直接用Ksp,而不管电离常数了。 溶解的氢氧化铁是完全电离的。氢氧化铁不是弱的吗?溶解的怎么是全部电离的?完全电离为什么还是弱电解质?碳酸钙硫酸钡不都算强电解质么...
 [注解与辨疑j] 常温下,浓度均为a的CH3COOH和CH3COONa混合液为什么显酸性? 作者:古盛兰 来源:未知 日期:2014-09-15 16:27:41 点击:985 所属专题:酸碱性
[注解与辨疑j] 常温下,浓度均为a的CH3COOH和CH3COONa混合液为什么显酸性? 作者:古盛兰 来源:未知 日期:2014-09-15 16:27:41 点击:985 所属专题:酸碱性
证明:已知25℃时CH 3 COOH的电离平衡常数 K a 约为1.75×10 ─5 , CH 3 COOH会发生电离,使溶液显酸性;CH 3 COONa会发生水解,使溶液显碱性。 因此,该混合液的酸碱性就取决于该混合液中CH 3 COOH电离产生 c (H + )与CH 3 COONa水解产生 c (OH ─ )的相对大...
 [注解与辨疑j] 常温下,浓度均为a的NH3H2O和NH4Cl混合液为什么显碱性? 作者:安勃 来源:未知 日期:2014-09-15 16:35:30 点击:1043 所属专题:酸碱性判断
[注解与辨疑j] 常温下,浓度均为a的NH3H2O和NH4Cl混合液为什么显碱性? 作者:安勃 来源:未知 日期:2014-09-15 16:35:30 点击:1043 所属专题:酸碱性判断
证明:已知25℃时NH 3 H 2 O的电离平衡常数 K b 约为1.76×10 ─5 , NH 3 H 2 O会发生电离,使溶液显碱性;NH 4 Cl会发生水解,使溶液显酸性。 因此,该混合液的酸碱性就取决于该混合液中NH 3 H 2 O电离产生 c (OH─)与NH 4 Cl水解产生 c (H + )的相对大...
 [注解与辨疑j] 非盐的水解反应---剧烈、放热、完全 作者:刘艳香 来源:未知 日期:2016-03-22 14:58:46 点击:1233 所属专题:非盐水解反应
[注解与辨疑j] 非盐的水解反应---剧烈、放热、完全 作者:刘艳香 来源:未知 日期:2016-03-22 14:58:46 点击:1233 所属专题:非盐水解反应
了解非盐类的水解,首先要区别于盐类的水解! 回忆:盐类的水解--在水溶液里,盐电离出的弱离子与水电离出的离子形成弱电解质的反应。特点是微弱、可逆、吸热。前提是盐能溶于水中,并电离出弱离子。 非盐类的水解则能发生剧烈、完全、放热的一类化合物。此类化合物可...
 [注解与辨疑j] 金属离子沉淀PH值 作者:丁萍 来源:未知 日期:2019-05-23 10:36:24 点击:15977 所属专题:沉淀分析法 金属离子沉淀ph值 化工条件控制
[注解与辨疑j] 金属离子沉淀PH值 作者:丁萍 来源:未知 日期:2019-05-23 10:36:24 点击:15977 所属专题:沉淀分析法 金属离子沉淀ph值 化工条件控制
金属离子沉淀PH值表格(20℃) 金属离子浓度 10^-1 10^-2 10^-3 10^-4 10^-5 pKsp In 3.27 3.6 3.93 4.26 4.59 33.2 Sn(二价离子) 0.57 1.07 1.57 2.07 2.57 27.8 Sn(四价离子) 0.25 0.5 0.75 1 1.25 56 Cd 7.7 8.2 8.7 9.2 9.7 13.6 Pb(二价离子) 7.04 7.54 8.04 8.54 9....
 [注解与辨疑j] 水溶液中的各种离子平衡常数与化学平衡常数的关系 作者:彭琳 来源:未知 日期:2021-01-20 09:11:17 点击:6814 所属专题:化学平衡常数 平衡常数
[注解与辨疑j] 水溶液中的各种离子平衡常数与化学平衡常数的关系 作者:彭琳 来源:未知 日期:2021-01-20 09:11:17 点击:6814 所属专题:化学平衡常数 平衡常数
在水溶液中常有许多平衡常数,如 K w 、 K a 、 K b 、 K sp 、 K h 等,它们分别代表什么意思?它们之间有什么关系?它们用于解决哪些化学问题?请看以下分析。 万变不离其宗,水溶液中的各种离子平衡都遵循化学平衡的特点,以上各种平衡常数与化学平衡常数有着明显的...
 [注解与辨疑j] 水溶液中的离子平衡中的易错判断 作者:黄勇 来源:未知 日期:2016-02-02 18:10:26 点击:1133 所属专题:电解质溶液 是非判断
[注解与辨疑j] 水溶液中的离子平衡中的易错判断 作者:黄勇 来源:未知 日期:2016-02-02 18:10:26 点击:1133 所属专题:电解质溶液 是非判断
( )1.某溶液中只含有 NH 4 + 、Cl - 、H + 、OH - ,若 c ( NH 4 + )= c (Cl - ),则溶液的pH=7 ( )2. 常温下,某物质的溶液的pH7,则该物质一定是酸溶液或强酸弱碱盐溶液 ( )3. 常温下,向纯水中加入钠或氢氧化钠都能使水的电离平衡逆向移动,水的离子积不...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【导读】与第一电离能定义相反(并非严格互逆过程),第一电子亲和能是指基态的气态原子...
【导读】 根据 质子酸碱 理论: 酸是 质子的给予体 , 给出质子 (H ) 的物质 ; 碱是 ...
电离概念是中学一个基本概念,用以区分电解质和非电解质、共价化合物和离子化合物。其...
1. 如何理解 “ 水解 ” 反应的概念? “ 水解 ” ,顾名思义,可理解为 “ 某物质遇...
为什么NaHCO 3 溶液能与Na[Al(OH) 4 ]溶液反应? NaHSO 3 溶液之所以能与Na[Al(OH) 4 ...
双水解程度计算: 同样是双水解,为什么CH 3 COO - 和 NH 4 + 可以大量共存,而Al 3...
我们在看到酸碱中和滴定图像时,看到反应一半点处图像很平缓,这是因为这一部分成分构...
请教:恒温下向CH 3 COONa稀溶液中加入少量固体醋酸钠 c (CH 3 COO - )/ c (Na + )...