
|
学习小专题 |

|
学习小专题 |
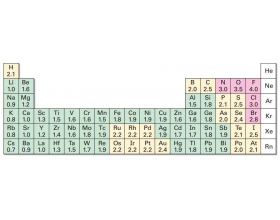 [注解与辨疑9] 如何判断NCl3中各元素的化合价? 作者:苑凌云 来源:追寻化学教育的本源 日期:2021-07-08 17:04:33 点击:3639 所属专题:化合价 三氯化氮
[注解与辨疑9] 如何判断NCl3中各元素的化合价? 作者:苑凌云 来源:追寻化学教育的本源 日期:2021-07-08 17:04:33 点击:3639 所属专题:化合价 三氯化氮
N、Cl的电负性相同,如何判断NCl 3 中各 元素的化合价呢? 基于NCl 3 的水解产物来看: 若不考虑NH 3 被HClO氧化,NCl 3 水解的总反应可表示为:NCl 3 +3H 2 O==NH 3 +3HClO (实际反应可能要复杂些,与反应的酸碱性环境有关) 酸性环境:2NCl 3 +3H 2 O==N 2 +3HClO...
 [注解与辨疑9] 氰、氢氰酸和氰酸等物质性质比较 作者:化学自习室 来源:未知 日期:2025-09-29 15:26:32 点击:7635 所属专题:氰化物
[注解与辨疑9] 氰、氢氰酸和氰酸等物质性质比较 作者:化学自习室 来源:未知 日期:2025-09-29 15:26:32 点击:7635 所属专题:氰化物
一、拟卤素 1、涵义 某些原子团形成的分子,与卤素单质分子的性质相似,它们的阴离子与卤素阴离子的性质也相似,所以常称它们为拟卤素。 2、重要的拟卤素有氰(CN) 2 、硫氰(SCN) 2 、硒氰(SeCN) 2 和氧氰(OCN) 2 。 比较 物质 单质 酸 盐 化学式 结构式 结构简式 化学式...
 [注解与辨疑9] 鉴别NO2和Br2的方法 作者:化学自习室 来源:未知 日期:2020-12-23 16:49:13 点击:2647 所属专题:物质鉴别04 二氧化氮
[注解与辨疑9] 鉴别NO2和Br2的方法 作者:化学自习室 来源:未知 日期:2020-12-23 16:49:13 点击:2647 所属专题:物质鉴别04 二氧化氮
鉴别物质的要求是:原理正确,方法简便,现象明显。 和 蒸气的一些性质很相似,如:①都是红棕色气体,有刺激性气味;②都具有较强氧化性,可以把 氧化为 ;③溶于水都显酸性。因此无法用观色态、闻气味、淀粉KI试纸或测定酸碱性的方法进行鉴别。那怎样才能将它们鉴别开...
 [注解与辨疑9] 浓H2S04的质量分数为多少? 作者:化学自习室 来源:未知 日期:2020-11-17 15:16:15 点击:621 所属专题:浓硫酸
[注解与辨疑9] 浓H2S04的质量分数为多少? 作者:化学自习室 来源:未知 日期:2020-11-17 15:16:15 点击:621 所属专题:浓硫酸
过去人们用铅室法制取H 2 SO 4 时,是根据质量分数小于75%的H 2 SO 4 不和铅反应(实际上是生成的难溶物H 2 SO 4 覆盖在Pb表面而使反应停止),可以用铅制容器来盛放H 2 SO 4 。所以,以前人们把浓度大于 75%的硫酸溶液称为浓H 2 SO 4 ,小于75%的硫酸溶液称为稀H 2 SO 4 ,后...
 [注解与辨疑9] 向BaCl2溶液中通入SO2气体无沉淀产生,有什么措施能产生沉淀? 作者:化学自习室 来源:未知 日期:2020-11-16 15:11:52 点击:662 所属专题:二氧化硫
[注解与辨疑9] 向BaCl2溶液中通入SO2气体无沉淀产生,有什么措施能产生沉淀? 作者:化学自习室 来源:未知 日期:2020-11-16 15:11:52 点击:662 所属专题:二氧化硫
弱酸不能制备强酸,所以无沉淀产生。 若要得到BaSO 4 沉淀可加入氧化性物质,如Cl 2 、HNO 3 、NO 2 、O 2 、O 3 、H 2 O 2 等; 若要得到BaSO 3 沉淀可加入碱性物质,如NH 3 、NaOH溶液、氨水等,若要得到S黄色沉淀,可以通入还原性H 2 S气体。...
 [注解与辨疑9] 在新制的硝酸亚铁溶液中,滴入少量的浓盐酸,为什么观察到溶液变黄 作者:化学自习室 来源:未知 日期:2020-11-16 08:59:39 点击:910 所属专题:硝酸盐
[注解与辨疑9] 在新制的硝酸亚铁溶液中,滴入少量的浓盐酸,为什么观察到溶液变黄 作者:化学自习室 来源:未知 日期:2020-11-16 08:59:39 点击:910 所属专题:硝酸盐
在硝酸亚铁溶液中加入浓盐酸发生两种变化: ①溶液中存在水解平衡:Fe 2+ +2H 2 O Fe(OH) 2 +2H + ,加入盐酸,使溶液中氢离子浓度增大,平衡左移,使溶液中亚铁离子的浓度增大,表现为浅绿色加深; ②溶液中同时有较多的氢离子和硝酸根离子,硝酸具有较强氧化性,即发...
 [注解与辨疑9] 有关浓硫酸氧化性的一些问题集 作者:化学自习室 来源:未知 日期:2020-01-30 15:00:45 点击:2780 所属专题:浓硫酸
[注解与辨疑9] 有关浓硫酸氧化性的一些问题集 作者:化学自习室 来源:未知 日期:2020-01-30 15:00:45 点击:2780 所属专题:浓硫酸
作为“强酸”中的一员,硫酸显然会具有“酸”的通性,也就是在理论上它可以与金属活动性顺序表中H前面的金属发生置换反应。严格地说,这是硫酸中H + 离子所表现出来的氧化性。 而把硫酸归入“氧化性酸”这一类物质,则针对的是H 2 SO 4 分子中处于最高价态的S(+6)所表现出...
 [注解与辨疑9] 有关硝酸问题集 作者:化学自习室 来源:未知 日期:2020-01-30 13:38:27 点击:1744 所属专题:硝酸
[注解与辨疑9] 有关硝酸问题集 作者:化学自习室 来源:未知 日期:2020-01-30 13:38:27 点击:1744 所属专题:硝酸
一、浓硝酸与紫色石蕊试液作用时,会不会先变红后褪色呢? 通过实验研究发现室温下将紫色石蕊试液滴入稀硝酸中,溶液立即变为红色,微热之,无明显变化发生;而室温下将紫色石蕊试液滴入浓硝酸中,溶液的颜色会由红色变为橙色,最后变为黄绿色,并伴随有大量红棕色气体产生...
 [注解与辨疑9] 有关二氧化氮问题集 作者:化学自习室 来源:未知 日期:2020-01-30 13:34:46 点击:1335 所属专题:二氧化氮
[注解与辨疑9] 有关二氧化氮问题集 作者:化学自习室 来源:未知 日期:2020-01-30 13:34:46 点击:1335 所属专题:二氧化氮
一、二氧化氮能不能用浓硫酸干燥? 实验表明:通入到浓H 2 SO 4 中浓烈的红棕色NO 2 气流经过浓硫酸时,我们发现红棕色的气体竟然是有进无出!没有一点气体外逸。在短时间内浓硫酸吸收NO 2 后,无色透明的浓硫酸没有颜色变化,大约经过2 min,吸收了更多的NO 2 ,浓硫酸才显...
 [注解与辨疑9] 亚硝酸及亚硝酸钠的性质及应用 作者:化学自习室 来源:未知 日期:2019-12-24 10:17:26 点击:10874 所属专题:亚硝酸 亚硝酸钠
[注解与辨疑9] 亚硝酸及亚硝酸钠的性质及应用 作者:化学自习室 来源:未知 日期:2019-12-24 10:17:26 点击:10874 所属专题:亚硝酸 亚硝酸钠
一、性质 1.亚硝酸(HNO 2 ) 亚硝酸是弱酸。向亚硝酸钠溶液中加酸,生成亚硝酸(HNO 2 )。亚硝酸不稳定,仅存在于冷的稀溶液中,微热甚至常温下也会分解,产生红棕色的二氧化氮气体。 NaNO 2 +H 2 SO 4 (稀)===NaHSO 4 +HNO 2 2HNO 2 ===NO↑+NO 2 ↑+H 2 O 2.亚硝酸钠(Na...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、拟卤素 1、涵义 某些原子团形成的分子,与卤素单质分子的性质相似,它们的阴离子...
一、 心概念与知识网络 “反应历程”或“反应机理”是近年来高考化学的热点。它不再是...
一、硫和金单质的反应 据我国古代第一部药物学专著《神农本草经》记载:“石硫黄(即硫...
高价态的含氧酸酸性强于低价态含氧酸的酸性,那么氧化性呢?比如,亚硝酸的氧化性就强...
...
浓硫酸和浓硝酸都具有氧化性,那么它俩谁更强呢?首先,必须确保同浓度下,水溶剂体系...
结构与性质 叠氮化钠(NaN 3 )亦称“三氮化钠”,化学式NaN 3 ,是六方晶体或白色结晶...
叠氮酸的化学式是HN 3 (与氨NH 3 不一样哦),也是一种氮的氢化物。 一、叠氮酸的结构 ...