
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑e] [Cu(NH3)4]2+是平面正方形构型吗? 作者:化学自习室 来源:未知 日期:2024-08-17 08:52:30 点击:722 所属专题:配合物结构 铜的配合物
[注解与辨疑e] [Cu(NH3)4]2+是平面正方形构型吗? 作者:化学自习室 来源:未知 日期:2024-08-17 08:52:30 点击:722 所属专题:配合物结构 铜的配合物
在高中化学教科书中对[Cu(NH 3 ) 4 ] 2+ 这样叙述:研究表明,在硫酸铜溶液中加入过量的氨水,溶液中生成了一种深蓝色的复杂离子[Cu(NH 3 ) 4 ] 2+ ,在[Cu(NH 3 ) 4 ] 2+ 中Cu 2+ 位于[Cu(NH 3 ) 4 ] 2+ 的中心,4个NH 3 分子位于Cu 2+ 四周(如图)。 图[Cu(NH 3 ) 4 ]...
 [注解与辨疑e] 怎样判断分子中有没有存在大π键? 作者:化学自习室 来源:未知 日期:2024-07-10 14:03:40 点击:903 所属专题:大π键
[注解与辨疑e] 怎样判断分子中有没有存在大π键? 作者:化学自习室 来源:未知 日期:2024-07-10 14:03:40 点击:903 所属专题:大π键
离域 π 键,也称大 π 键,是物质结构中的困惑之最。 大π 键肯定也是 π 键,所以也一定要符合 π 键的要求: 中心原子肯定在原有杂化轨道形成 σ 键的基础上还有没参与杂化的 p 轨道。也就是说,p 轨道没有全部参与杂化,因此中心原子可能采取 sp,sp 2 杂化。 而且...
 [注解与辨疑e] 怎样判断分子中有没有存在π键? 作者:化学自习室 来源:未知 日期:2024-07-10 13:58:35 点击:417 所属专题:π键
[注解与辨疑e] 怎样判断分子中有没有存在π键? 作者:化学自习室 来源:未知 日期:2024-07-10 13:58:35 点击:417 所属专题:π键
离域 π 键,也称大 π 键,是物质结构中的困惑之最。 大π 键肯定也是 π 键,所以也一定要符合 π 键的要求:中心原子肯定在原有杂化轨道形成 σ 键的基础上还有没参与杂化的 P 轨道。也就是说,P 轨道没有全部参与杂化,因此中心原子可能采取 sp,sp 2 杂化。 相关链...
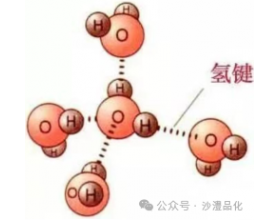
 [注解与辨疑e] 氢键深度理解 作者:化学自习室 来源:未知 日期:2024-03-26 10:54:35 点击:1741 所属专题:氢键
[注解与辨疑e] 氢键深度理解 作者:化学自习室 来源:未知 日期:2024-03-26 10:54:35 点击:1741 所属专题:氢键
氢键 氢原子与电负性大、半径小的原子X(氟、氧、氮等)以共价键结合,若与电负性大的原子Y(与X相同的也可以)接近,在X与Y之间以氢为媒介,生成X-H…Y形式的一种特殊的分子间或分子内相互作用,称为氢键。[X与Y可以是同一种类分子,如水分子之间的氢键;也可以是不同种类分...
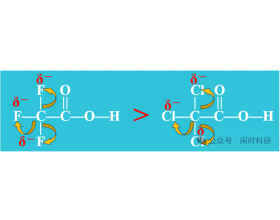 [注解与辨疑e] 碳酸与乙酸,甲酸的酸性比较 作者:化学自习室 来源:未知 日期:2024-03-20 08:43:14 点击:734 所属专题:羧酸酸性
[注解与辨疑e] 碳酸与乙酸,甲酸的酸性比较 作者:化学自习室 来源:未知 日期:2024-03-20 08:43:14 点击:734 所属专题:羧酸酸性
在“键的极性对化学性质的影响”一节中,高中阶段将会学习诱导效应对羧基的羟基的极性的影响。但所学知识相对简单: 即:拉电子集团使羟基的极性增强,从而使羧酸的酸性增强。 推电子集团使羟基的极性减弱,从而使羧酸的酸性减弱。 但是在解决以下题目时,依然存在困惑...
 [注解与辨疑e] 分子结构与性质基础知识常见问题集 作者:化学自习室 来源:未知 日期:2024-03-19 15:41:44 点击:576 所属专题:分子结构与性质
[注解与辨疑e] 分子结构与性质基础知识常见问题集 作者:化学自习室 来源:未知 日期:2024-03-19 15:41:44 点击:576 所属专题:分子结构与性质
1.共价键是如何形成的? 自旋相反的未成对电子可配对形成共价键,共价键的本质是在原子之间形成共用电子对(电子云的重叠),成键原子间原子轨道尽可能达到最大程度的重叠,重叠程度越大,体系能量降低越多,所形成的共价键越稳定。形成共价键的原子可以是非金属与非金属元素...
 [注解与辨疑e] 形成氢键是否需要孤对电子? 作者:化学自习室 来源:未知 日期:2024-03-20 07:57:38 点击:2832 所属专题:氢键 孤对电子
[注解与辨疑e] 形成氢键是否需要孤对电子? 作者:化学自习室 来源:未知 日期:2024-03-20 07:57:38 点击:2832 所属专题:氢键 孤对电子
是的,形成氢键需要有孤电子对。 氢键的形成主要与强极性的含氢化合物有关,需要有强电负性的原子存在,如氟、氧、氯、氮等。这些原子的孤对电子会给到氢原子的外层空轨道,使得氢原子和强电负性原子之间产生吸引力,形成氢键。 需要注意的是,一个氢键中必定包含一对孤...
 [注解与辨疑e] 有关“分子间氢键”对分子晶体熔沸点的影响问题集 作者:化学自习室 来源:未知 日期:2024-03-13 09:57:36 点击:590 所属专题:氢键与熔沸点
[注解与辨疑e] 有关“分子间氢键”对分子晶体熔沸点的影响问题集 作者:化学自习室 来源:未知 日期:2024-03-13 09:57:36 点击:590 所属专题:氢键与熔沸点
问题①: 第三周期中的几种非金属元素的氢化物的沸点: CH 4 NH 3 H 2 O ,为什么? 【 析 】: CH 4 分子间为范德华力, NH 3 、 H 2 O 有分子间氢键,使其分子间的作用力增大,熔沸点升高。 氢化物 C H 4 NH 3 H 2 O H F 熔点 / ℃ -182.5 -77.7 0 -83.7 沸点 / ℃ -1...
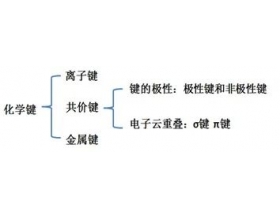 [注解与辨疑e] 分子极性的判断与比较 作者:化学自习室 来源:未知 日期:2024-03-13 07:14:30 点击:5760 所属专题:分子极性判断
[注解与辨疑e] 分子极性的判断与比较 作者:化学自习室 来源:未知 日期:2024-03-13 07:14:30 点击:5760 所属专题:分子极性判断
一、化学键的极性 分子的极性是由化学键的极性产生的: 非极性键: 成键的两个原子电负性相同,共用电子对不偏移。 极性键:成键的两个原子电负性不同,共用电子对偏移。 成键的两个原子的电负性差越大,键的极性越大;若电负性差超过 1.7 ,可以认为该化学键是离子键;...
 [注解与辨疑e] 羧酸与卤代羧酸的酸性比较---诱导效应 作者:化学自习室 来源:未知 日期:2024-03-13 07:10:07 点击:1776 所属专题:羧酸酸性
[注解与辨疑e] 羧酸与卤代羧酸的酸性比较---诱导效应 作者:化学自习室 来源:未知 日期:2024-03-13 07:10:07 点击:1776 所属专题:羧酸酸性
诱导效应: 由于电负性不同的取代基的影响,使整个分子中成键电子对的电子云按取代基的电负性所决定的方向发生偏移的效应叫做诱导效应。 诱导效应分为吸电子诱导效应(如卤素原子)和给电子诱导效应(如烃基)。 p K a=-lg K a ,酸的电离常数 K a 越大, p K a 越...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。[2025湖北新八校2月卷] 8 . 从微观视角探析物质结构及性质是学习化学的有效方法。下列...
含氮(N)的杂化化合物是指氮原子通过轨道杂化形成化学键的化合物。氮原子的电子构型...
在化学中均裂和异裂是共价键的断裂的两种主要方式,其决定因素不同:均裂主要由键能决...
通常而言,同主族元素形成的X-X键,自上而下,键长逐渐增大,键能逐渐降低。 根据元素...
无机化学实验是一门与无机化学理论课密切配合的课程。实验用化学事实充实了理论课的学...
能否形成氢键的“视点”:一看有无电负性...
1mol 氨中氢键数量分析 一、氢键形成机制 NH分子结构 H原子作为氢键供体(需与高电负性...
二氧化氮(NO)中氮原子的杂化类型为 sp杂化,具体分析如下: 1.计算 n (的价层电子对数...