
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑e] 稳定性涵义探析 作者:罗云峰 来源:未知 日期:2012-10-25 09:50:12 点击:10430 所属专题:稳定性
[注解与辨疑e] 稳定性涵义探析 作者:罗云峰 来源:未知 日期:2012-10-25 09:50:12 点击:10430 所属专题:稳定性
在化学学习过程中,经常碰到有关物质的稳定性的描述,但稳定性的涵义不尽相同。本文想通过一些实例说明稳定性的内涵。 第一类:分子中化学键的稳定性。主要说明物质是否易分解。如某类物质对热的稳定性、对光的稳定性等。 常见的例子有气态氢化物的稳定性。其稳定性大小规律...
 [探讨与扩展a] 共价键的键参数和分子的性质 作者:孙禹 来源:未知 日期:2013-11-13 17:05:06 点击:19127 所属专题:共价键
[探讨与扩展a] 共价键的键参数和分子的性质 作者:孙禹 来源:未知 日期:2013-11-13 17:05:06 点击:19127 所属专题:共价键
一、共价键的参数与意义 1、键能:气态原子形成1mol化学键所释放的能量。共价键的键能与键长一起用于解释原 子晶体的熔点沸点的高低;与键长一起用于解释共价分子的稳定性;用于解释反应物和生成物都是气体的反应的 △ H。 2、键长:形成共价键的两个原子之间的核间距。...
 [注解与辨疑e] 等电子体与杂化类型的判断方法归纳 作者:姚小伟 来源:未知 日期:2016-05-08 17:02:30 点击:21413 所属专题:等电子体 杂化类型判断
[注解与辨疑e] 等电子体与杂化类型的判断方法归纳 作者:姚小伟 来源:未知 日期:2016-05-08 17:02:30 点击:21413 所属专题:等电子体 杂化类型判断
《2009年江苏省高考说明(化学科)》的选考内容“物质结构与性质”课程模块中对“等电子原理”、“杂化轨道理论”考点是这样描述的:了解“等电子原理”的含义,能结合实例说明“等电子原理”的应用;能根据杂化轨道理论和价层电子对互斥模型判断简单分子或离子的空间构型...
 [探讨与扩展a] 共价键的四个键参数 作者:羊绍敬 来源:未知 日期:2012-12-03 10:53:10 点击:7236 所属专题:共价键
[探讨与扩展a] 共价键的四个键参数 作者:羊绍敬 来源:未知 日期:2012-12-03 10:53:10 点击:7236 所属专题:共价键
共价键的四个键参数(反映键特征的数据叫做键参数) 1、键长:假设形成共价键(单键、双键、三键)的两个原子都是球体,并且外切,球心间的距离(即成键原子的核间距)叫做该共价键的键长。(单位通常取十的负十次方米。)【A─A键长的一半,就是A原子的半径(叫做共价...
 [注解与辨疑e] 为什么原子轨道在形成化学键时要进行杂化? 作者:刘柳 来源:未知 日期:2013-03-12 15:19:29 点击:9366 所属专题:杂化轨道
[注解与辨疑e] 为什么原子轨道在形成化学键时要进行杂化? 作者:刘柳 来源:未知 日期:2013-03-12 15:19:29 点击:9366 所属专题:杂化轨道
“为什么原子轨道在形成化学键时要进行杂化?”对这个问题,我认为可以从轨道杂化的可能性和必要性这两个方面加以说明: (1)为什么原子轨道可能进行杂化?因为电子具有波动性,不同的波在一定条件下有相互叠加而形成新的波的性质。因此,原子在化合过程中,受其它原子...
 [探讨与扩展a] 化学键是如何“给力”的? 作者:谢文芳 来源:未知 日期:2012-12-03 10:52:24 点击:13056 所属专题:化学键
[探讨与扩展a] 化学键是如何“给力”的? 作者:谢文芳 来源:未知 日期:2012-12-03 10:52:24 点击:13056 所属专题:化学键
宇宙存在四种作用力:电磁力、强力、弱力和万有引力,物理学家相信,这四种力在宇宙初期是同一种力,所以可以用同一套理论来描述。 有人用水波来形象的说明这四种力的关系:在一池平静的水塘里扔下一个石头,水中最先形成的小范围水波的力是最强的,这就如同强力和弱力,是...
 [探讨与扩展a] 铝跟卤素化合,生成的卤化物是离子化合物,还是共价化合物? 作者:王欣华 来源:未知 日期:2012-12-03 10:56:40 点击:7263 所属专题:氯化铝 离子化合物 共价化合物
[探讨与扩展a] 铝跟卤素化合,生成的卤化物是离子化合物,还是共价化合物? 作者:王欣华 来源:未知 日期:2012-12-03 10:56:40 点击:7263 所属专题:氯化铝 离子化合物 共价化合物
一般来说,活泼金属跟活泼非金属化合能形成离子化合物。但Al 3+ 由于电荷数高,半径小(0.51×10 -10 m),极化能力较强。而Cl - 、Br - 、I - 等离子半径大(分别为1.81×10 -10 m、1.96×10 -10 m、2.20×10 -10 m),它们易于变形。当Al 3+ 跟Cl - 、Br - 、I - 等结...
 [探讨与扩展a] 决定共价键极性强弱的因素 作者:陈爱玉 来源:未知 日期:2012-12-03 10:57:50 点击:23582 所属专题:键的极性
[探讨与扩展a] 决定共价键极性强弱的因素 作者:陈爱玉 来源:未知 日期:2012-12-03 10:57:50 点击:23582 所属专题:键的极性
在共价化合物中形成弱极性键或强极性键是由哪些因素来决定的?电负性差值达到什么程度,极性键就转变为离子键? 在共价化合物中,由于不同元素的原子吸引电子的能力不同,共用电子对就必然或多或少地偏向于对它吸引力较大的那个原子(即电子云密度大的地方将偏近于这个...
 [注解与辨疑e] 分子结构规律——最大对称原理 作者:黄惠 来源:未知 日期:2022-12-08 16:45:16 点击:42236 所属专题:分子空间结构判断
[注解与辨疑e] 分子结构规律——最大对称原理 作者:黄惠 来源:未知 日期:2022-12-08 16:45:16 点击:42236 所属专题:分子空间结构判断
化合物中的中心原子周围的电子对之间总是尽可能最大角度地对称分布,因为共用电子之间的角度越大,对称性越高,它们之间的同性排斥力就必然越小,这样分子就必然越稳定。这个规律不妨叫做最大对称原理。 只有当中心原子周围的电子对(或共价键)相同时,它们才可能最大...
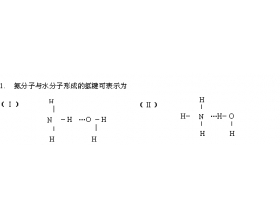 [注解与辨疑a] 氢键中的两个问题集 作者:徐俊龙 来源:浙江省慈溪市观城中学 日期:2024-03-13 08:36:00 点击:9492 所属专题:氢键与熔沸点
[注解与辨疑a] 氢键中的两个问题集 作者:徐俊龙 来源:浙江省慈溪市观城中学 日期:2024-03-13 08:36:00 点击:9492 所属专题:氢键与熔沸点
1. 为什么 HF 分子间氢键比 H 2 O 分子间氢键强,而 HF 的沸点却比 H 2 O 的低? 由于氟原子半径比氧原子小,电负性大于氧,所以 HF 分子间的 F - H … F 氢键比 H 2 O 分子间的 O — H … O 氢键要强得多,前者键能为 28KJ/mol, 后者 18.8KJ/mol 。即使在气态时, HF ...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。[2025湖北新八校2月卷] 8 . 从微观视角探析物质结构及性质是学习化学的有效方法。下列...
含氮(N)的杂化化合物是指氮原子通过轨道杂化形成化学键的化合物。氮原子的电子构型...
在化学中均裂和异裂是共价键的断裂的两种主要方式,其决定因素不同:均裂主要由键能决...
通常而言,同主族元素形成的X-X键,自上而下,键长逐渐增大,键能逐渐降低。 根据元素...
无机化学实验是一门与无机化学理论课密切配合的课程。实验用化学事实充实了理论课的学...
能否形成氢键的“视点”:一看有无电负性...
1mol 氨中氢键数量分析 一、氢键形成机制 NH分子结构 H原子作为氢键供体(需与高电负性...
二氧化氮(NO)中氮原子的杂化类型为 sp杂化,具体分析如下: 1.计算 n (的价层电子对数...