
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
近年高考试题中,元素及其化合物部分的试题一直是紧靠中学教学内容,涉及较多的基本知识点,特别是各部分知识的进一步融合。在选择题和无机方框图推断题中,都在重点考查元素及其化合物知识,同时配合考查考生的实验能力、计算能力,这已经是多年高考试题的一种稳定的固定模式,为此我们必须搞好该知识板块的复习。
一、全面复习元素及其化合物的各部分知识
高考试题的已知信息中,个性化条件减少,物质的特性、特殊反应条件和现象都隐蔽化,而共性化条件的试题模式日显突出,单线突破的试题模式淡化,这就要求考生必须全面复习,具有全面、牢固的系统知识,才能对此类题作答,同时也增强作答的准确性,减少不必要的丢分。为此应引导学生全面复习,将各类元素、化合物的知识整理,形成一些规律性的、系统性的知识。重点应作好以下几点:
1、把握好《大纲》要求和命题趋势
《大纲》要求:重点掌握典型金属、非金属及其化合物的性质,如碱金属侧重于考查钠及过氧化钠的性质推断,卤族元素侧重于考查氯气的化学性质;了解其它常见金属(Mg、Al、Fe)非金属(H、O、S、N、P、C、Si)的单质及某些氧化物、氢化物和盐的性质。
高考热点趋势:Na2O2与H2O、CO2反应的实验,CO2与NaOH反应的计算,Al2O3、Al(OH)3的两性,Mg与CO2反应,铝三角、铁三角涉及的双水解,![]() 的转化现象,同时NaH、Mg3N2、Al2S3水解也是信息题的好素材。Cl2、S在碱性条件下发生反应(X2 + 2OH- = X- + XO- + H2O , 3S + 6OH- = 2S2- + SO32_ 3H2O),在酸性条件下发生归中反应:(5X- + XO3- +6H+ = 3X2 + 3H2O,2S2- + SO32- + 6H+ =3S↓+3H2O);N2、S的氢化物,高低价氧化物,含氧酸之间的相似转化模式,高温下氧化物转化为单质的模式 C + H2O
的转化现象,同时NaH、Mg3N2、Al2S3水解也是信息题的好素材。Cl2、S在碱性条件下发生反应(X2 + 2OH- = X- + XO- + H2O , 3S + 6OH- = 2S2- + SO32_ 3H2O),在酸性条件下发生归中反应:(5X- + XO3- +6H+ = 3X2 + 3H2O,2S2- + SO32- + 6H+ =3S↓+3H2O);N2、S的氢化物,高低价氧化物,含氧酸之间的相似转化模式,高温下氧化物转化为单质的模式 C + H2O ![]() H2 + CO , H2 O + CO
H2 + CO , H2 O + CO![]() H2 + CO2 , 3CO + Fe2O3
H2 + CO2 , 3CO + Fe2O3![]() 2Fe +3CO2 ,2C + SiO2
2Fe +3CO2 ,2C + SiO2![]() Si +2CO↑ )等。运用元素及其化合物的性质和相互转化关系进行物质的推断和检查。
Si +2CO↑ )等。运用元素及其化合物的性质和相互转化关系进行物质的推断和检查。
2、物质的颜色、气味、实验现象的掌握和归类
如某些沉淀的颜色:
①Fe(OH)3红褐色:Fe(OH)2白色沉淀,迅速转变为灰绿色,最后变成红褐色沉淀;②不溶于酸的黑色沉淀:CuS、Ag2S、PbS;溶于酸的黑色沉淀:FeO、CuO、Fe3O4、MnO2(浓HCl);③浅黄色沉淀:AgBr;④黄色沉淀:AgI、S、Ag3PO4;⑤蓝色沉淀:Cu(OH)2;⑥白色沉淀:AgCl、BaSO4、BaCO3、CaSO4、Ag2 SO4、Mg(OH)2、Al(OH)3;⑦红色:Cu2O、Cu。
如某些气体的特征性质:
|
化学式 |
颜色、气味 |
特征性质 |
|
NH3 |
无色、刺激性气味 |
使湿润的红色石蕊试纸变蓝,极易溶于水(1:700) |
|
Cl2 |
黄绿色、刺激性气味 |
使湿润的KI淀粉试纸变蓝,能溶于水(1:2) |
|
HCl |
无色、刺激性气味 |
酸性气体,易溶于水(1:500) |
|
H2S |
无色、臭鸡蛋气味 |
使湿润的Pb(NO3)2试纸变黑,能溶于水(1:2.6) |
|
SO2 |
无色,刺激性气味 |
使品红溶液褪色,易溶于水(1:40) |
|
CO2 |
无色、无味 |
使澄清石灰水变浑浊,能溶于水(1:1) |
|
NO |
无色、无味 |
遇空气变红棕色,不溶于水 |
|
NO2 |
红棕色、刺激性气味 |
易溶于水得无色溶液(HNO3) |
3、物质的组成、结构的掌握和归类
如两种元素可形成AB或A2B化合物:
①当均为液态(或共价化合物)时,是H2O2 、H2O;
②当均为固态(或离子化合物)时,是Na2O2、Na2O(或CuO、Cu2O,是含长周期元素)。
如两种元素可形成AB或AB2化合物:
①当均为固态时,是FeS 、FeS2;
②当均为气态时,是CO、CO2(或NO、NO2等)
4、物质的重要反应的掌握和归类
常见的特殊反应类:
Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O Si+2NaOH+H2O===Na2SiO3+2H2↑
![]()
![]() 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 3Fe + 4H2O
2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 3Fe + 4H2O![]() Fe3O4 + 4H2
Fe3O4 + 4H2
SO2+Cl2+2H2O===H2SO4+2HCl 4HF + SiO2 = SiF4+2H2O
SiO2+ ![]() Si +2CO↑ 2FeSO4
Si +2CO↑ 2FeSO4![]() Fe2O3 + SO2↑+SO3↑
Fe2O3 + SO2↑+SO3↑
歧化反应与归中反应类:
常见的歧化反应:
![]()
![]() Cl2+2NaOH===NaCl+NaClO+H2O
Cl2+2NaOH===NaCl+NaClO+H2O
3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
3S + 6NaOH ![]() 2 Na2S + Na2SO3 +3H2O
2 Na2S + Na2SO3 +3H2O
2H2O2![]() 2H2O + O2↑ 2Na2O2 +2CO2 = 2Na2CO3 + O2↑
2H2O + O2↑ 2Na2O2 +2CO2 = 2Na2CO3 + O2↑
2Na2O2 +2H2O = 4NaOH + O2↑ 3NO2 + H2O =2HNO3 +NO
常见的归中反应:
2Na2S +Na2SO3 +6HCl = 6NaCl + 3S↓+3 H2O 8NH3 +6NO2 = 7N2 + 12H20
4NH3 +6NO = 5N2 + 6H20 2Fe3+ + Fe = 3Fe2+
Ca(ClO)2 +4HCl(浓) = 2Cl2↑ + CaCl2 +2H2O [KClO3与Ca(ClO)2相似]
2H2S+SO2 = 3S↓+2H2O S +2 H2SO4(浓)![]() 3 SO2 ↑+ 2H2O
3 SO2 ↑+ 2H2O
5、抓好每一个知识点的复习质量
例如《硫酸性质》的复习:
①浓硫酸的物理性质:A、密度与质量分数的关系(应注意“浓”是一个范围,ρ与ω成正比);B、恒沸溶液(98.3%的浓H2SO4有固定的沸点,说明有固定沸点的物质不一定是纯净物);C、吸水性与脱水性的区别(分别体现的例子)。
②涉及浓硫酸的实验操作:A、浓硫酸的稀释;B、浓硫酸与另外溶液混合(如酯化反应的反应物);C、硫酸根的检验方法;D、浓硫酸引发的事故处理;E、浓硫酸与稀硫酸的鉴别。
③浓硫酸与稀硫酸的区别:A、浓度标准;B、性质差异
④浓硫酸的性质与用途(整理常考的点):A、干燥剂;B、浓硫酸+Cu;C、KMnO4溶液中加硫酸;D、制乙烯;E、酯化反应;F、酯的水解反应;G、苯的硝化;H、蔗糖水解。
![]() ⑤工业制硫酸原理:
⑤工业制硫酸原理:
![]()
![]() 4FeS2+11O2
4FeS2+11O2 ![]() 8SO2+2Fe2O3; 2SO2+O2 2SO3; SO3+H2O====H2SO4
8SO2+2Fe2O3; 2SO2+O2 2SO3; SO3+H2O====H2SO4
⑥相关知识发散:A、HSO4-存在的环境;B、NaHSO4与Ba(OH)2离子反应方程式书写;C、酸碱等体积中和,C(酸)=C(碱)或C(H+)=C(OH-),溶液酸碱性判断;D、离子方程式中的书写形式。
二、抓好典型元素的转化关系模式的对比与归纳
引导学生在学习元素的重要性质的同时,要善于整理总结,找出它们具有哪些相似的、规律性的转化关系,并努力做到能迁移到试题中作答。
如直线型多次氧化转化型:
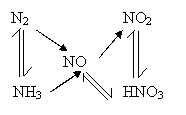
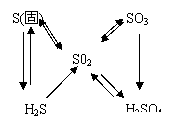
、
可多次连续氧化,存在多种价态氧化物。
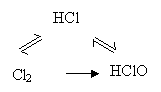
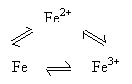 如三角转化型:
如三角转化型:
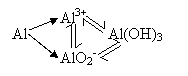
 例1、已知A、B、C、D之间在不同条件下有如下图示的简单转化关系:A、B、C、D分别代表中学化学中常见的物质(粒子)。请按要求写出有关反应式,是离子反应的只写离子方程式(有多种情况的,只写其中一种情况)。
例1、已知A、B、C、D之间在不同条件下有如下图示的简单转化关系:A、B、C、D分别代表中学化学中常见的物质(粒子)。请按要求写出有关反应式,是离子反应的只写离子方程式(有多种情况的,只写其中一种情况)。
(1)若A、D为同主族元素组成的单质,B、C为化合物。
①B是水:______________________________________。
②B、C均为氧化物(反应有重要的工业价值):_________________,工业价值是________________________。
(2)若A、D的组成元素不同主族:
①B是水且水是还原剂:__________________________________________________。
B是水且水是氧化剂(反应有重要的工业价值):_____________________________。
工业价值是__________________________。
②B、C均为氧化物:____________________________________________________。
(3)若A、D均为金属单质,B为黑色有磁性固体,则A与B反应的化学方程式为:_________________________________________________________________________ 。
(4)若A、B、D是化合物,C是气态单质,则化学方程式为___________________。
(5)若A、B、C、D均为10电子粒子,则离子方程式为:_____________________ 。
(6)若A、B是易溶物质,C、D是难溶物质,则A、B的化学方程式为:_____________________________。
例2、A、B、C、D、E五种物质的相互转化关系如图所示:
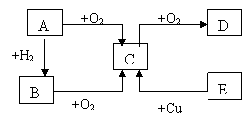
试回答:
(1)若A通常状态下为固体单质,则A~E分别为(写化学式):
A__________________; B__________________; C_____________________;
D__________________; E__________________。
(2)若A通常状态下为气体单质,则A~E分别为(写化学式):
A__________________; B__________________; C_____________________;
D__________________; E__________________。
(3)写出(2)中物质间转化的离子方程式E→C:______________________。
三、注重无机框图推断题的解法和强化训练
学习无机框图题的解法,主要的环节有:
1、审题:看清题目中的文字说明,列出解题的关键字词;找出框图中的实验现象和变化规律;审查框图中的物质、反应条件、反应过程。
2、找解题突破口:
①寻找特征反应和现象:按题干所给的特定颜色、气味、状态、实验现象特性。
②从物质的组成、结构方面找:如等电子体微粒,10e-电子体有:CH4、NH3、H2O、S2-、F-、Na+、Mg2+、Al3+、OH-、NH4+、H3O+等;18e-电子体主要有:H2S、HCl、H2O2、S2-、Cl-、K+、Ca2+、O22-等。
③从反应类型方面找:试题往往没有明显、准确的突破口,而是一个几种元素、化合物都可能合题意的转化关系模式,可利用转化关系尝试法,对有可能的物质一一加以推证,找出其中的唯一性与排它性。
例3、(2006年全国Ⅱ)以下一些氧化物和单质之间可以发生如图所示的反应:

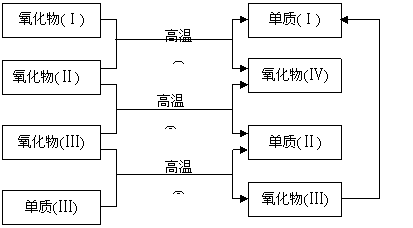
其中,氧化物(Ⅰ)是红棕色固体,氧化物(Ⅱ)、(Ⅲ)、(Ⅳ)在反应条件下都是气体。
(1)氧化物(Ⅰ)的化学式(分子式)是______________________________。
氧化物(Ⅱ)的化学式(分子式)是______________________________。
(2)反应①的化学方程式是___________________________________。
反应②的化学方程式是___________________________________。
反应③的化学方程式是___________________________________。
例4、已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转化关系如下图所示:
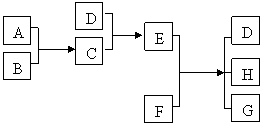
(1)D的化学式(分子式)是_____________,E的化学式(分子式)是___________;
(2)A和B反应生成C的化学方程式是_________________________________;
(3)E和F反应生成D、H和C的化学方程式是__________________________ 。
例5、(2006年四川)A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1:2。在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):
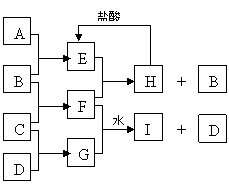
请填写下列空白:
(1)A是______________,C是________________。
(2)H与盐酸反应的化学方程式是_____________________________________。
(3)E与F反应的化学方程式是_______________________________________。
(4)F与G的水溶液反应生成I和D的离子方程式是:
_____________________________________________________________。
例6、A、B、C、D代表单质或化合物,它们之间的相互转化关系如下图所示。A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似
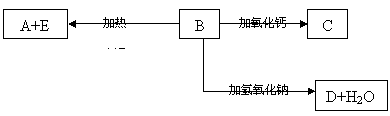
请填空:
(1)形成单质A的原子的结构示意图为_________,它的最高化合价为_________;
(2)B的化学式(分子式)为__________,B的晶体类型为_________,B和碳反应生成A和E的化学方程式是________________________________;
(3)C的化学式(分子式)为__________,D的化学式(分子式)为____________ 。
3、验证:在无机框图题推断中,要将所得结果代入框图,看是否符合在框图中的变化关系,是否符合题干所给已知条件,是否与我们所学知识矛盾。在答题时应注意:①答名称,还是符号、化学式、电子式、结构式等;②答离子方程式,还是化学方程式;③答现象,还是结论;④答规律,还是具体物质或具体内容。防止过失丢分。
注:参考文献
①《2007年高三化学复习的思考及建议》,刘远信。
②《新高考》(物化生)。
③《天府名校》。
④《导与练》。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【导读】“强酸制弱酸”是复分解反应的常见规律,其本质是强酸电离出的H更易与弱酸根...
在高中化学中,很多同学从初中就学习了复分解反应, 都知道复分解反应中“强酸制弱酸...
1.水银:汞Hg 2.过氧一硫酸:过氧硫酸过硫酸 H 2 SO 5 3.白金:主要成分铂 Pt 4.苯:C...
...
元素种类 对应物质的常考易错点 N 性质:(1)浓HNO 3 和Cu(足量)在反应时,随反应进行...
例题1:浓硫酸与金属反应的条件 题目:常温下,浓硫酸能否与金属铁发生反应? 错误答...