
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
(一)金属部分
一、如何复习无机物质的化学性质
1、复习无机物质的化学性质,主要从五个方面入手:
(1)分析它的强氧化性或强还原性,对应的化学反应为氧化还原反应。
如金属单质的还原性,非金属单质的氧化性或还原性,H2S(HS-、S2-)、SO2(HsO3-、SO32-)、I-、Fe2+、H2C2O4(HC2O4-、C2O42-)的强还原性,MnO4-、Cr2O72-、ClO-、H2O2、Na2O2、HNO3、Fe3+的强氧化性等。
(2)分析它的酸碱性、电离能力和溶解能力,对应的化学反应为水溶液中的复分解反应。
主要有酸碱中和、强酸制弱酸、强碱制弱碱、生成难溶盐、双水解反应、络合反应六种反应类型。
(3)分析它的稳定性,对应的化学反应为分解反应。
如带结晶水的盐不稳定,铵盐不稳定,硝酸盐不稳定,弱碱不稳定,弱碱的碳酸盐不稳定,银盐不稳定等。
(4)分析它在高温下形成稳定物质或挥发性物质的能力,对应的化学反应为高温下的反应。
注意高温下的反应有时不能用氧化还原能力的强弱、酸碱性的强弱来分析,而是用挥发性、结合能力分析。
比如,Al和Si是亲氧元素,碰到氧元素易结合为Al2O3、SiO2或偏铝酸盐、硅酸盐,所以地壳中这几种物质特别多。
在高温下易发生铝热反应,Al2O3、SiO2与碳酸盐的反应。
Al+Fe2O3=高温=2Fe+Al2O3、SiO2+CaCO3=高温=CaSiO3+CO2↑、Al2O3+CaCO3=高温=Ca(AlO2)2+CO2↑,后两个反应与酸性强弱无关。
H3PO4+NaI=Δ=NaH2PO4+HI↑,此反应与酸性强弱无关。
KCl+Na=高温=NaCl+K↑,此反应与金属性(还原性)无关。
(5)分析它的特性。看它是否有特殊的化学反应。
2、选择对应的反应对象:
不管哪种物质,一般在考虑反应对象时,都主要从单质(金属、非金属)、化合物(氧化物、酸、碱、盐)等几类物质中选择。
3、相似的物质,反应类型也相似。
(1)金属单质,只会做还原剂,发生氧化还原反应。反应的对象有非金属、氧化物、酸、盐。
(2)还原性的非金属单质,主要做还原剂,发生氧化还原反应。反应的对象有氧化性非金属、氧化物、氧化性酸、氧化性盐。
(3)氧化性的非金属单质,主要做氧化剂,发生氧化还原反应。反应的对象有金属、还原性非金属、水、还原性酸、碱、还原性盐。
(4)金属氧化物,一般是碱性氧化物,发生复分解反应中的中和反应。反应对象有酸或酸性氧化物。
(5)非金属氧化物,有些是酸性氧化物,发生复分解反应中的中和反应。反应对象有碱或碱性氧化物。
(6)碱,发生复分解反应中的中和反应。反应对象有酸或酸性氧化物。弱碱都不稳定,受热易分解。与有些非金属发生反应。
(7)酸,发生复分解反应中的中和反应。反应对象有碱或碱性氧化物。很多含氧酸不稳定。常与金属发生反应。
(8)盐,弱酸或弱碱的盐,能发生复分解反应中的水解反应。弱酸盐能制弱酸,弱碱盐能制弱碱。有些能生成难溶盐。铵盐、硝酸盐、酸式盐、带结晶水的盐、弱碱的碳酸盐都不稳定,易分解。
(9)带S(-2)、S(+4)、Fe(+2)的化合物多数有强还原性。带Fe(+3)、N(+5)、Mn(+7)、Cr(+6)、Cl(+1、+5)的化合物多数有强氧化性。
二、如何利用元素化合物的相互转化图快速复习元素化合物的化学性质
1、钠
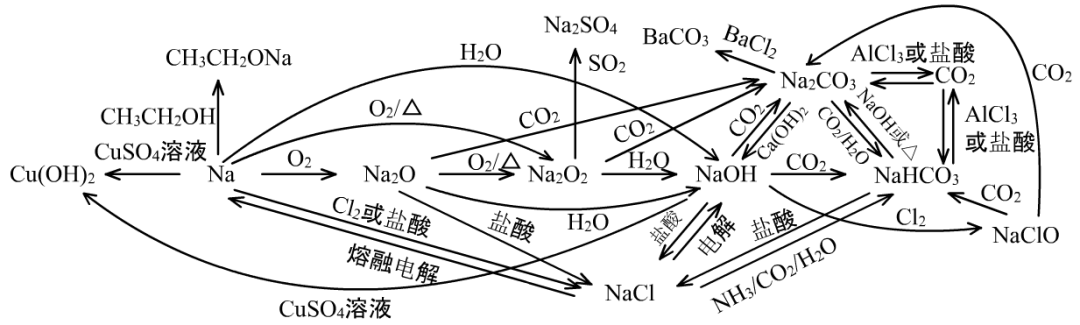
(1)以钠及化合物的图像为例说明如何利用图像复习物质的化学性质
①复习图像中的Na(单质)
它的反应应该考虑与非金属、氧化物、酸、盐的反应。观察Na周围向外的箭头,有和O2、Cl2、H2O、盐酸、CuSO4溶液、乙醇的反应,与上面的物质类别基本对应。
需要强调的是,Na与乙醇的反应是有机物的反应类型。Na与O2的反应,分为常温和加热两种情况。Na与各种物质的水溶液反应,一般先和水反应,生成的NaOH再和溶液中其它物质进行反应。
②复习图像中的NaOH
它的反应应该主要考虑它作为碱和强碱的性质(复分解反应),主要与酸性氧化物、酸、弱碱盐反应。观察NaOH周围向外的箭头,有和CO2、盐酸、CuSO4溶液的反应,与上面的物质类别相对应。
③对于图像中NaHCO3、Na2CO3、CO2等的化学性质,与Na+基本没有什么关系,主要学习的是碳酸及碳酸盐的性质。NaCl也是如此。
(2)本图像中几个比较特殊的反应
①2Na2O+O2=Δ=2Na2O2
②Na2O2和H2O、CO2的反应与和SO2反应的不同:
Na2O2和H2O、CO2的反应,并不与Na2O2的强氧化性有关,而与Na2O2不稳定有关。可以看作Na2O2不稳定,歧化为NA2O和1/2O2,然后Na2O与H2O生成2NaOH或与CO2生成Na2CO3。
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
Na2O2和SO2的反应,与Na2O2的强氧化性有关:
Na2O2+SO2=Na2SO4
③Na与CuSO4溶液的反应,先发生的是NA与H2O的反应,生成的NaOH再与CuSO4发生强碱制弱碱的反应。
2Na+2H2O=2NaOH+H2↑ 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
合起来得:2Na+2H2O+CuSO4= Cu(OH)2+Na2SO4+H2↑
④NaOH与CO2反应的过量问题:
这相当于是一元强碱与二元弱酸(H2CO3)中和反应,中和反应的本质是碱的OH-与酸的H+中和生成H2O。当碱过量时,二元酸的两个H会被完全中和,生成正盐:
2NaOH(过量)+CO2= Na2CO3+H2O
当碱不足时,二元酸的两个H不会被完全中和,生成酸式盐:
NaOH(少量)+CO2= NaHCO3
⑤Na2CO3、NaHCO3与AlCl3、FeCl3发生双水解反应。
双水解反应发生在易生成沉淀或气体的弱酸盐和弱碱盐之间,产物为弱酸或弱碱。
3Na2CO3+2AlCl3+3H2O=2Al(OH)3↓+3CO2↑+6NaCl
3NaHCO3+FeCl3=Fe(OH)3↓+3CO2↑+3NaCl
⑥侯氏制碱法的第一步反应为
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
此反应的操作顺序是在饱和NaCl溶液中先通入过量的NH3,再通入过量的CO2,原因是:用饱和NaCl是为让Na+的浓度更高。后通过量的CO2才能得到HCO3-,若后通过量NH3,得到的是CO32-。先通过量NH3,可以提高CO2的反应量和溶解量,得到更多的HCO3-。
⑦Na2CO3+CO2+H2O=2NaHCO3
此反应的反应原理,也是强一点的酸制弱一点的酸。
⑧NaOH与Cl2的反应,代表了NaOH(碱)的另一种性质,与一些非金属会反应,发生歧化反应或置换反应。但在此过程中,NaOH只是提供了强碱性环境,并不起氧化或还原作用。
NaOH+Cl2=NaCl+NaClO+ H2O
2NaOH+Si+ H2O=Na2SiO3+2H2↑
⑨电解熔融NaCl得到Na和Cl2,这个氧化还原反应并不能说明NaCl具有强氧化性或强还原性。
2、铝
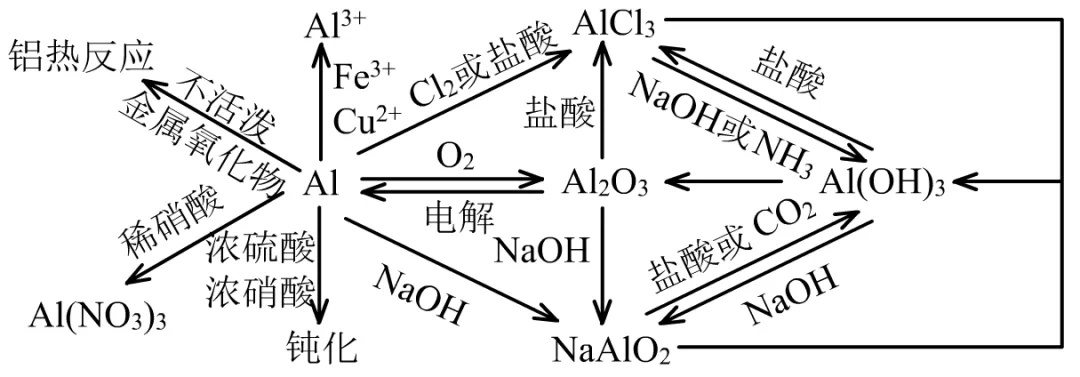
(1)铝的性质特殊在它的金属、化合物都常常体现出两性。
如铝也有非金属性,与碱能反应。
①2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Al2O3和Al(OH)3都有两性(酸性和碱性)。
②Al2O3+2NaOH=2NaAlO2+H2O
③Al(OH)3+NaOH=2NaAlO2+2H2O
注意Al(OH)3作为酸时是一元弱酸,比碳酸弱。所以:
④NaAlO2+HCl+H2O=Al(OH)3↓+NaCl
⑤2NaAlO2+CO2(少量)+3H2O =2Al(OH)3↓+ Na2CO3
(2)关于AlCl3或NaAlO2的过量问题
由于Al(OH)3有两性,它与过量的强酸或强碱都能反应。但与NH3•H2O、CO2等不反应。
①当AlCl3溶液中滴加NH3•H2O至过量时,没有过量问题。
AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl
当AlCl3溶液中滴加NaOH至过量时,有过量问题。
AlCl3+4NaOH= NaAlO2+3NaCl+2H2O
②当NaAlO2溶液中通入CO2至过量时,没有Al(OH)3的过量问题。
NaAlO2+CO2(过量)+2H2O =Al(OH)3↓+ NaHCO3
当NaAlO2溶液中滴加盐酸至过量时,有Al(OH)3的过量问题。
NaAlO2+4HCl= AlCl3+NaCl+2H2O
(3)AlCl3溶液与NaAlO2溶液的双水解反应
AlCl3是在较强的酸性溶液中才能存在的盐,NaAlO2是在较强的碱性溶液中才能存在的盐,否则容易水解出现浑浊。
当两种溶液混合在一起时,会发生双水解反应:
AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3 NaCl
注意:当NaAlO2溶液滴入NaHCO3溶液时,不是双水解问题,而是弱酸制更弱的酸的问题。
NaAlO2+NaHCO3=Al(OH)3↓+ Na2CO3
(4)Al遇浓硫酸、浓硝酸有钝化现象,在表面形成致密氧化膜。
3、镁
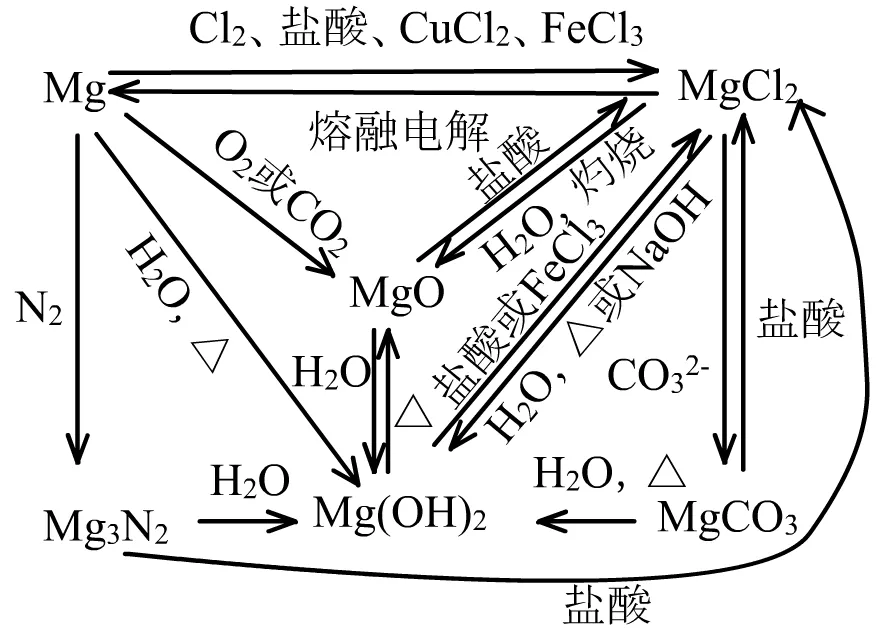
(1)Mg是典型的较活泼金属。
没有Al的两性,MgO、Mg(OH)2是碱性氧化物、碱。Mg及化合物与碱一般不发生反应。
也没有钠的特别活泼,与O2反应时不生成过氧化物,与水反应时需要加热:Mg+2H2O=Mg(OH)2+H2↑。
(2)Mg及化合物的特殊性质主要有:
①Mg能与N2反应:3Mg+N2=点燃=Mg3N2
②Mg能在CO2中燃烧:2Mg+CO2=点燃=2MgO+C
③Mg3N2能水解:Mg3N2+6H2O=3Mg(OH)2+2NH3↑
金属的氮化物、碳化物、硫化物等都有这种水解的性质。
④Mg3N2+8HCl=3MgCl2+2NH4Cl
⑤MgO能与水生成碱:MgO+H2O=Mg(OH)2
⑥MgCl2水溶液加热蒸干:MgCl2+2H2O=Δ=Mg(OH)2+2HCl↑
这种性质在AlCl3、FeCl3、CuCl2等卤化物中都存在。
⑦MgCl2水溶液灼烧:MgCl2+H2O=灼烧=MgOH+2HCl↑
⑧Mg(OH)2悬浊液中加FeCl3溶液可以转化为红褐色沉淀:
3Mg(OH)2+2FeCl3=3MgCl2+2Fe(OH)3
4、铁
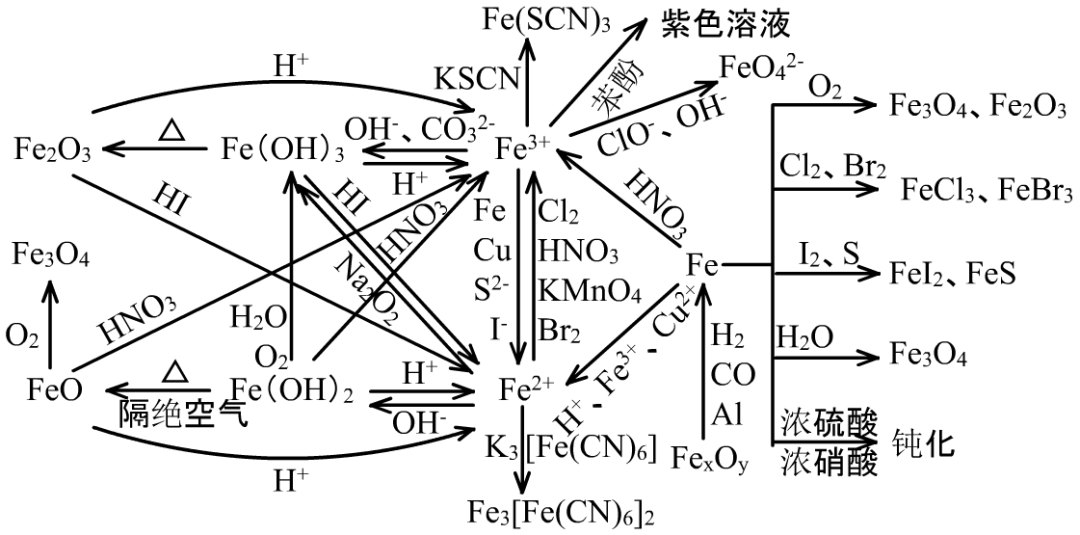
(1)Fe的化学性质很特殊,它的反应的特殊性在于有两个价态+2、+3,它的+2有较强的还原性,它的+3有较强的氧化性。在每一个反应中对Fe的价态的定位是一个难点。在每一个反应中既要考虑复分解反应,又要考虑氧化还原反应,是又一个难点。
例如,FeO是碱性氧化物,与稀盐酸、稀硫酸反应时,是复分解反应:FeO+2HCl=FeCl2+H2O。
但FeO与具有强氧化性的稀硝酸反应时,是氧化还原反应:3FeO+10HNO3=3Fe(NO3)3+NO↑+5H2O。
(2)Fe及化合物的特殊性质主要有
①Fe与非金属反应时,非金属的氧化能力不同,生成产物中Fe的价态不同。
Fe与氧化能力强的Cl2、Br2反应生成+3价的FeCl3、FeBr3,与氧化能力不强的I2、S反应生成+2价的FeI2、FeS。与O2反应在不同条件下,生成不同价态的产物。
②Fe与热的水蒸气反应,生成Fe3O4:
3Fe+4H2O(g)=高温= Fe3O4+4H2
③Fe与Fe3+、Cu2+、H+、原电池或电解池的电极溶解反应中,一般都生成Fe(+2)。
Fe与稀硝酸、浓硫酸、浓硝酸的加热反应中,先生成Fe(+3)。
④FeO在空气中加热,能转化为Fe3O4:6FeO+O2=Δ= 2Fe3O4
⑤FeO、Fe(OH)2与稀HCl、稀H2SO4发生的是复分解反应,与稀HNO3发生的是氧化还原反应。
Fe(OH)2+H2SO4=FeSO4+2H2O
3Fe(OH)2+10 HNO3= 3Fe(NO3)3+NO↑+8H2O
Fe2O3、Fe(OH)3与稀HCl、稀H2SO4发生的是复分解反应,与稀HI发生的是氧化还原反应。
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+6HI= 2Fe I2+I2+3H2O
⑥Fe2+的可溶性盐主要发生
I、强碱制弱碱的复分解反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl
II、与强氧化剂的氧化还原反应:
10FeSO4+2KMnO4+8 H2SO4=5Fe2(SO4)3+K2SO4+2MnSO4+8H2O
III、与K3[Fe(CN)6]生成蓝色难溶盐沉淀Fe3[Fe(CN)6]2:
3FeCl2+2K3[Fe(CN)6]=Fe3[Fe(CN)6]2↓+6KCl
⑦Fe3+的可溶性盐主要发生
I、强碱制弱碱的复分解反应:FeCl3+3NaOH=Fe(OH)3↓+3NaCl
II、与Na2CO3、NaHCO3、NaAlO2、Na2SiO3的双水解反应:
2FeCl3+3Na2CO3+3H2O=2 Fe(OH)3↓+3CO2↑+6NaCl
III、与强还原剂的氧化还原反应:
2FeCl3+Na2S =2FeCl2+S↓+2NaCl
IV、与KSCN生成血红色溶液Fe(SCN)3:
FeCl3+3KSCN= Fe (SCN)3+3KCl
V、被强氧化剂氧化为高铁酸盐:
2FeCl3+3NaClO+10NaOH=2Na2FeO4+9NaCl+5H2O
高铁酸盐既有强氧化性,能杀菌消毒,产物又能水解为胶体,吸附水中的悬浮物产生沉淀,是非常好的净水剂。
5、铜
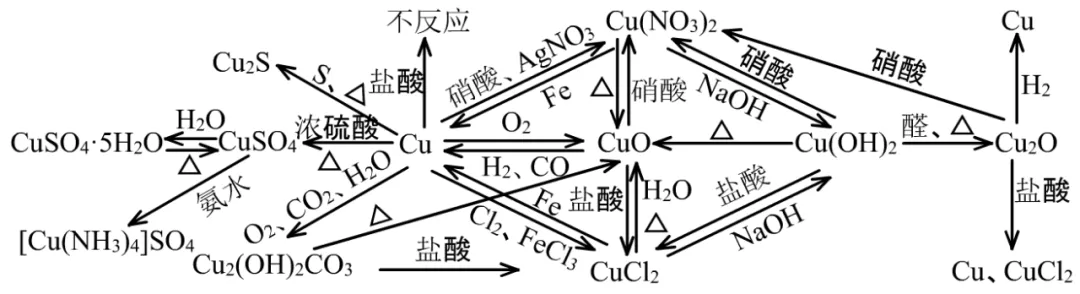
(1)铜是活泼性很低的金属。它的化合物中主要存在+2、+1两种价态。它还是一种重金属,Cu2+带有一定的毒性。
Cu与非金属反应时,与氧化能力强的Cl2、Br2、O2生成+2价的CuCl2、CuBr2、CuO。与氧化能力不强的I2、S生成+1价的CuI、Cu2S。
Cu与稀HCl、稀H2SO4等氧化能力不强的酸不反应,与浓H2SO4、浓HNO3、稀HNO3等强氧化性的酸反应。
Cu+2 H2SO4(浓)=Δ= CuSO4+SO2↑+2 H2O
Cu+4 HNO3(浓)= Cu(NO3)2+2NO2↑+2 H2O
3Cu+8 HNO3(稀)= 3Cu(NO3)2+2NO↑+4 H2O
铜的化合物都既有可能发生复分解反应,也有可能发生氧化还原反应。
(2)Cu及化合物的特殊性质主要有:
①Cu在自然界中能与CO2、H2O、O2反应生成Cu2(OH)2CO3:
2Cu+ O2+CO2+H2O= Cu2(OH)2CO3
②Cu2(OH)2CO3受热能分解:Cu2(OH)2CO3=Δ=2CuO+CO2↑+ H2O
③Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
④2Cu(OH)2+NaOH+R-CHO→Δ→R-COONa+Cu2O+3H2O
⑤Cu2O遇非强氧化性的酸能发生歧化反应
Cu2O+2HCl= CuCl2+Cu+H2O
⑥新制Cu(OH)2能溶于氨水,能形成深蓝色溶液。
Cu(OH)2+4NH3•H2O=[Cu(NH3)4](OH)2+4H2O
【练习】
1.实验室欲测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250 mL 溶液。
方案一:沉淀法。利用化学反应把HCO3-、CO32-完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中W(Na2CO3)。
(1)量取100mL 配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选用的试剂是________(填字母)。
A.CaCl2溶液 B.MgSO4溶液 C.NaCl溶液 D.Ba(OH)2溶液
(2)过滤,洗涤沉淀,判断沉淀是否洗净的方法是___________________。
(3)将所得沉淀充分干燥,称量沉淀的质量为Mg,由此可以计算W(Na2CO3)。如果此步中,沉淀未干燥充分就称量,则测得W(Na2CO3)________(填“偏大”“偏小”或“无影响”)。
方案二:量气法。量取10.00mL 配制好的溶液与足量稀硫酸反应,测定生成气体在通常状况(约20℃、1.01×105Pa)的体积,由此计算混合物中W(Na2CO3)。
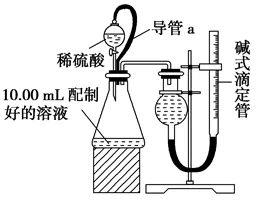
(1)装置中导管a的作用是___________________________。
(2)若撤去导管a,使测得气体体积________(填“偏大”“偏小”或“无影响”)。
2.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
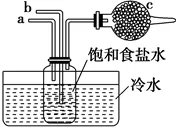
A.a通入CO2,然后b通入NH3,C中放碱石灰
B.b通入NH3,然后a通入CO2,C中放碱石灰
C.a通入NH3,然后b通入CO2,C中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3,C中放蘸稀硫酸的脱脂棉
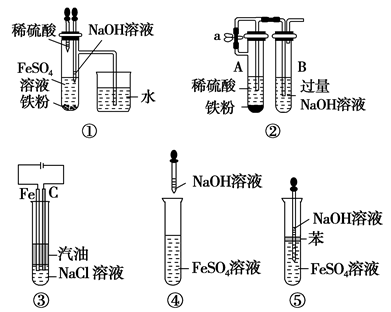
3.下列各图示中,能较长时间观察到Fe(OH)2白色沉淀的是________。
4.某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取出少量黑色固体,洗涤后,_________________(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是_____________________________(用离子方程式表示)。
针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
Ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
Ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
Ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
②根据3-30min的变化,可以推理出溶液中发生的反应是 。
5.从宏观现象探究微观本质是重要的化学学科素养。以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:
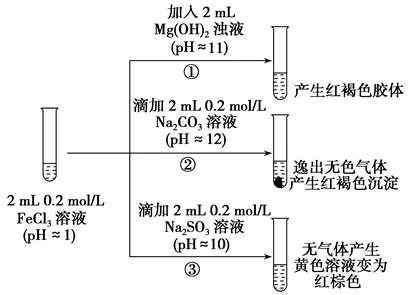
(1)①中反应的离子方程式是_________________________________。
(2)②中逸出的无色气体是________。从物质类别的角度分析,Na2CO3与Na2SO3在化学性质方面的共性是____________________________(写一条);从化合价角度分析,Na2CO3与Na2SO3在化学性质方面的差异是___________(写一条)。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
Ⅰ.甲取③中的红棕色溶液少许,滴入盐酸酸化的BaCl2溶液,产生白色沉淀。甲得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是____________。
Ⅱ.乙认为甲的实验不严谨,重新设计并进行实验,证实了甲的结论是正确的。其实验方案是___________________________________。
(4)受以上实验的启发,同学们对pH≈8的1mol/L NaF溶液与FeCl3溶液混合时的现象产生了好奇并进行实验:
实验操作及现象 | ④向2 mL 0.2 mol/L FeCl3溶液中滴入2 mL 1 mol/L NaF溶液,溶液变无色 |
⑤向2 mL 0.2 mol/L FeCl3溶液中滴入2 mL 蒸馏水,溶液颜色变浅 |
Ⅰ.⑤的实验目的是_______________________________________________。
Ⅱ.为探究④中溶液变无色的原因,进行如下实验:
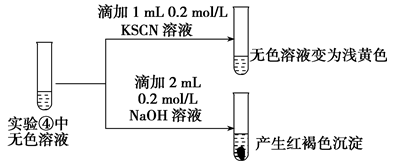
资料显示:FeF3溶液为无色。
用平衡移动原理解释红褐色沉淀产生的原因:_____________________。
【练习答案】
1.方案一:(1)D (2)取少量最后一次洗涤液,滴加Na2SO4溶液,如无沉淀,则沉淀已洗净,反之则未洗净 (3)偏小
方案二:(1)平衡气压,使液体顺利滴下 (2)偏大
2.C
3.①②③⑤
4.(1)①加入足量稀盐酸(或稀硫酸)酸化,固体未完全溶解 ②Fe2+
(2)①Fe+2Fe3+=3Fe2+②Fe2++Ag+=Fe3++Ag
5.(1)3Mg(OH)2+2Fe3+=2Fe(OH)3(胶体)+3Mg2+
(2)CO2 两者都为强碱弱酸盐,能与强酸反应 Na2CO3中碳原子为最高正价+4,无还原性;Na2SO3中硫原子为+4价,处于中间价态,具有较强的还原性
(3)I.2Fe3++SO32-+H2O=2Fe2++SO42-+2H+
II.取③中的红棕色溶液少许,滴加铁氰化钾溶液,出现蓝色沉淀
(4)I.排除加水稀释对溶液颜色变化的影响
II.无色溶液中存在平衡:Fe3++3F-⇌FeF3,加入NaOH后,Fe3+更易与OH-结合生成难溶的Fe(OH)3
(5)碱性物质的pH、离子的性质

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。78 号铂 Pt 、 79 号金 Au 、 80 号汞 Hg 、 82 号铅 Pb 、 92 号铀 U 。 一、铂 78 P...
一、银47Ag 银亲硫,极化能力强。在自然界中常以自然银、硫化物等形式存在,因其离子...
一、镓Ga 从铝土矿Al 2 O 3 或闪锌矿Zns的冶炼过程中提取,最后经电解制得纯净镓。 门...
一、铁 Fe 古代社会铁器时代大约起始于 前 2000 年 ,最早发现和使用的铁是来自外空的...
一、钪Sc 1、单质是柔软、银白色。熔点1500℃以上。钪常用来制特种玻璃、轻质耐高温合...
一、氢 H 1 、 H ,是原子半径最小的元素,有 H (氕)、 D (氘)、 T (氚)等核素...