
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
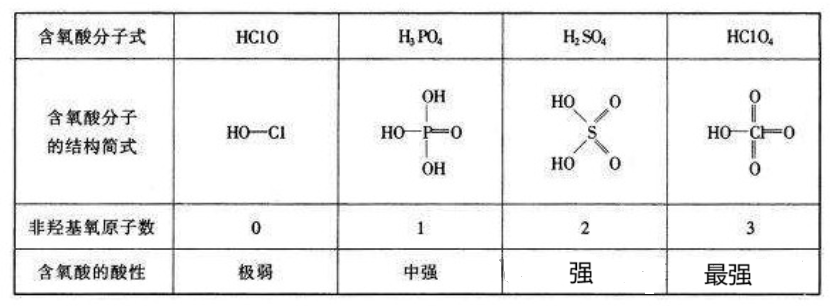
鲍林在研究含氧酸时,将其化学式一般写作 HₘROₙ,其中 R 代表中心原子,羟基(–OH)与非羟基氧原子共存。鲍林发现,含氧酸的酸性主要取决于分子中非羟基氧原子(n)的数量。当 n 增加时,R 原子的氧化态提高,其电负性增强,从而对羟基氧起到较强的电子拉吸作用,使 O–H 键极化加剧,H⁺ 更容易离解。简言之,非羟基氧原子越多,酸性越强。例如:
硅酸(H₄SiO₄)
中心原子硅的氧化态较低(n = 0),酸性非常弱;
磷酸(H₃PO₄)
含有 1 个非羟基氧(n = 1),酸性中等;
硫酸(H₂SO₄)
含有 2 个非羟基氧(n = 2),酸性强;
高氯酸(HClO₄)
含有 3 个非羟基氧(n = 3),属于极强酸。
鲍林对强弱酸的划定
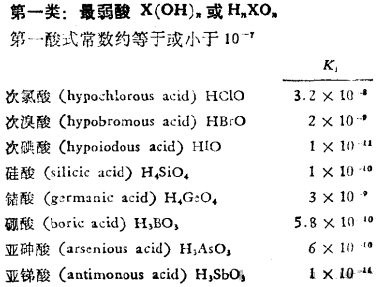
按上述规则,鲍林的划分如下:
最弱酸:
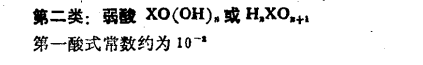



例外的酸:


 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。元素种类 对应物质的常考易错点 N 性质:(1)浓HNO 3 和Cu(足量)在反应时,随反应进行...
例题1:浓硫酸与金属反应的条件 题目:常温下,浓硫酸能否与金属铁发生反应? 错误答...
鲍林在研究含氧酸时,将其化学式一般写作 HRO,其中 R 代表中心原子,羟基(–OH)与...
...
一、银47Ag 银亲硫,极化能力强。在自然界中常以自然银、硫化物等形式存在,因其离子...
一、镓Ga 从铝土矿Al 2 O 3 或闪锌矿Zns的冶炼过程中提取,最后经电解制得纯净镓。 门...