
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!

HCl、HI、HNO3、HClO4等强酸在水中“完全电离”,因而它们同浓度水溶液的pH相同,这意味着它们酸的强度是相同的。然而,这些强酸结构中与可电离氢原子结合的化学键并不相同,为什么电离能力相同呢?
我们不能忘记,酸在水中电离出氢离子是与水分子作用的结果:
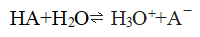
强酸在水中表现出相同的强度是由于与它们作用的水夺取质子的能力“过强”之处。如果换一个更弱的质子接受体,在水中具有相同强度的“强酸”就会显示出不同的强度来,例如若把这些酸溶解在无水甲醇里,它们的酸性将通过如下反应而得以呈现:
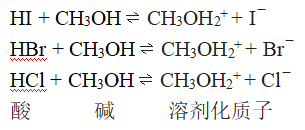
由于甲醇作为碱结合质子的能力大大低于水,在甲醇中HI、HBr和 HCl的强度就不会相同。
用多种非水溶剂进行测定实验,已经证明,水中的一些常见强酸的强度的顺序为:
HClO4>HI>HBr>HCl>HNO3>H2SO4(一级电离)
溶剂(如水)将酸的强度拉平的效应简称拉平效应,该溶剂也称拉平溶剂;溶剂(如甲醇)使强酸的强度得以显出差别的效应称为区分效应,该溶剂因而也称区分溶剂。水是 HCl、HBr 、HI 的拉平溶剂,却是 HCl、HNO2、CH3COOH、HCN 的区分溶剂。如果把水中呈现不同强度的某些酸溶解到夺取质子能力比水强得多的液氨中,由于液氨的拉平效应,将使它们的强度区分不出来。
溶剂对酸的强度的不同效应在实践上是可以找到应用的。例如,某些中强的二元酸的第一级电离和第二级电离由于水的拉平效应相差太小,致使在水中用强碱滴定它们时一级电离的终点和二级电离的终点会混在一起,若改用无水乙醇为溶剂,由于乙醇的区分效应可使该酸的两级电离的强度有较大的区别可将两级滴定终点区分开来。
——《无机化学》(北师版)
考试中的拉平效应和区分效应
在一些考试中,我们是不愿意看到区分效应的。因为,我们希望每一个学生都“合格”,比如衡量是否达到毕业标准的“结业考试”,这种考试通过降低难度将学生拉平了,学习能力无法区分。而人才的选拔,我们则希望考试能起到区分的作用,难度自然提高,如高考。对某些学生而言,可能高考也只是他们的“拉平考试”,竞赛才是高手之间的“区分考试”。
不管是“拉平效应”还是“区分效应”,溶剂很关键,即所处的环境。但环境不是永恒的,是变化的,酸的自身性质才起决定作用。
对人而言,环境的影响固然重要,而又很微妙。当发现自己就是“强酸”时,可能是被暂时的环境“拉平”了,时间的洗礼和岁月的磨砺会将真正的强者区分出来。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。酸碱滴定法 强酸滴定强碱的反应 强酸滴定弱碱的反应 混合碱的滴定(双指示剂法+滴定突...
【学生疑问】 教材上有两个实验,一个是 AgI 转化为 Ag 2 S,一个是 Mg(OH) 2 转化为 ...
25 ℃ 时, K a1 (H 2 S)=1.1 × 10 -7 ; K a2 (H 2 S)=1.3 × 10 -13 . (高等教育...
沉淀转化是沉淀溶解平衡的应用之一。 对于溶度积较大的沉淀转为溶度积较小的沉淀这类...
1.实例 常温下,用0.100 0 mol·L -1 NaOH溶液滴定20.00 mL 0.100 0 mol·L -1 CH 3...
问题呈现:pH=5的稀盐酸加水冲稀1000倍,稀释后溶液的pH=?请通过计算说明。 错解:由...