
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
题目:
根据VSEPR理论,对于IBrCl3-:
(1)计算其中心原子的价层电子对数;
(2)画出几何构型;
(3)指出孤电子对数;
(4)给出分子构型的名称;
(5)对分子结构中键角可能偏离理想构型的情况给予简单说明。
解析:
中心原子:I
配位原子(共4个):1个Br-,3个Cl-
中心原子价层电子:中心原子碘(7个)
配位原子溴(1个)
配位原子氯(1×3个)
离子带电荷(1个)
中心原子价层电子对总数:
7+1+3+1=12,6对
其中:成键电子对:4对,
孤对电子对:2对。
所以:
中心原子杂化方式:sp3d2
价层电子对构型:八面体
因为有孤对电子,而且配位原子不一样,所以电子对之间的距离不一样,也就是价层电子对构型是八面体而不是正八面体。
分子构型:2 对孤对电子占据八面体对角位置,分子构型呈平面四方型
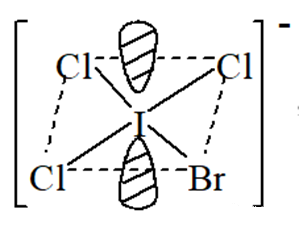
结构解析:谁决定了键角的大小
平面四边型的四个成键电子对的位置是等同的,三个 Cl-和1个Br-分别占据其中一个,但是Br 的电负性小于 Cl 的电负性,所以 I-Br 的成键电子对相对 I-Cl更偏向于中心原子,则角ClIBr将大于角 ClICl。
答案:
(1)成键电子对 4 对,孤对电子对 2 对。
(2)

(3)2 对孤电子对;
(4)平面四方型;
(5)角 ClICl 将小于角 ClIBr 。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。分析: 依据价层电子对数计算公式分析, 可得价层电子对数=5=[2+3],故有2个配位原子...
...
比较键角大小分析思路: 参照以下顺序来判断键角大小 ①先从中心原子的杂化类型来入手...
顺反异构中,分子的对称性、极性以及熔点和沸点存在以下差异: 1.对称性比较 反式异构...
01 — 概念 在多原子分子(就是三个或三个以上的原子构成的分子)中,如有相互平行的p...
含有共价键的物质中相邻两键之间的夹角称为键角。键角是决定物质分子空间构型的主要因...