
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
路易斯结构式源于路易斯结构理论,又称为八隅体理论。该理论的基本要点如下:一个共价 化合物(或共价分子)能够稳定存在,是由于电子对的共享使每个原子能够形成一种稳定的稀有气体电子构型。在书写路易斯结构式时,两原子间以短线相连,孤对电子用小黑点表示。
对于简单的分子或离子通过观察即可确定如何书写。如:水、氨、乙酸、氮气的路易斯结构式如 下:
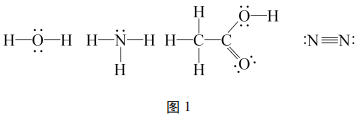
在书写时,注意一定不要漏写孤对电子。
复杂的分子或离子的路易斯结构式的书写则 必须通过计算,排列、判断等一系列步骤才能准确 书写。下面就以HN3为例,介绍如何分步书写路 易斯结构式。
第一步:计算出分子(或离子)中的成键数和孤对电子数。
设n0为共价键分子(或离子)为达到八隅体 所需电子总数,nv为共价键分子(或离子)的价电 子总数。在构成路易斯结构时,原子提供的价电子数,是按周期表的族数给出的。ns为所有原子 之间共享的电子数。
对于HN3分子:
n0= 2+3×8 = 26
nv= 1+3×5 = 16
成键数:
ns/2=(n0-nv) /2=(26-16) /2=5
孤对电子对数:
(nv-ns) /2= (16-10) /2 = 3
第二步:画出分子的基本骨架,两原子间以短线相连,然后标出孤对电子。
在链状分子中,一般电负性较小的原子居中, 而H及电负性较大的原子(如O、Cl)则处于端基 的位置。依次排好各个原子的位置后,先用单键将原子连接起来。如下式所示:
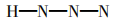
H—N—N—N 由上式可知一个HN3分子中有3个σ键,由计算 知成键数为5,则可知有2个π键。由上计算可 知有3对孤对电子,故可写出如下三种路易斯结 构式:
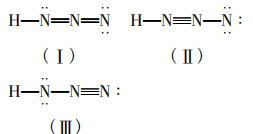
第三步:标上形式电荷Qf ,判断其稳定性。
形式电荷Qf=原子的价电子数-成键电子数 -孤电子数
以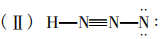 为代表来计算各原 子的形式电荷,然后标上。
为代表来计算各原 子的形式电荷,然后标上。
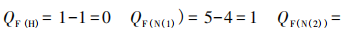
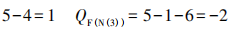
以相同方法计算并标出另外两个路易斯结构式的形式电荷。
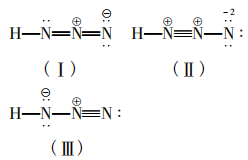
由稳定性的判断依据可知:在路易斯结构式中Qf应尽可能小,若共价分子中所有原子的形式电荷均为零,则是最稳定的路易斯结构式。若相邻原子间的形式电荷为同号,这种结构是不稳定 的。所以三个路易斯结构式中(Ⅱ)是不稳定的, (I) (Ⅲ)比较稳定。比较稳定的这两种结构式 互称为共振式,表示如下:
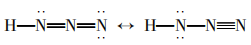
再看硝酸,硝酸可能的路易斯结构式有以下三种,同样可以根据形式电荷来判断它们的稳定
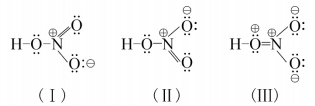
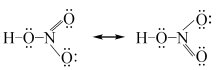
(Ⅲ)中相邻的O和N的形式电荷均为+ 1, 不稳定。(I)、(Ⅱ)较稳定。硝酸的共振式如 下:
例1 (第28届中国化学奥林匹克)2013年, 科学家通过计算预测了高压下固态氮的一种新结 构:N8分子晶体。其中,N8分子呈首尾不分的链状结构;按照价键理论,氮原子有4种成键方式; 除端位以外,其他氮原子采用3种不同类型的杂化轨道。
3-1画出的Lewis 结构式并标出形式电荷。
3-2 略。
解第一步:计算出分子中的成键数和孤对电子数。对于N8分子,n0=8×8=64,nv=5×8=40
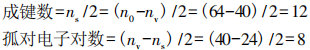
第二步:画出分子的基本骨架,两原子间以短线相连,然后标出孤对电子。
在本题中,由题目给出条件“链状结构”,可写成如下形式。
N—N—N—N—N—N—N—N
由成键数为12,且分子内有7个σ键,可推 知应有5个π键。由“N8分子首尾不分的链状结 构”可知呈对称结构。除端位以外,其它氮原子 采用3种不同类型的杂化轨道,即sp、sp2、sp3这 三种杂化方式。则分子中存在三键,双键。可以写出以下两种:
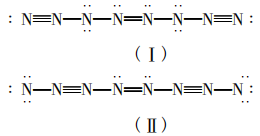
第三步:标上形式电荷Qf,判断其稳定性。
根据题目要求,计算(I ) (Ⅱ )的形式电荷。从左往右氮原子标号为1-8,计算形式电荷,标注。
(I)的具体计算过程如下:
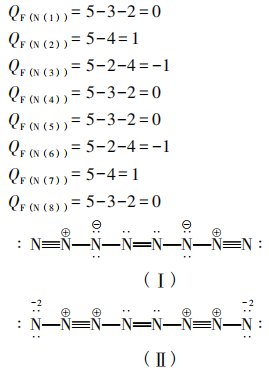
通过分析可以看出(Ⅱ)式不稳定,舍去。
例2氟硫氮化合物是一类重要的化合物,假如SNF、NSF均存在,试写出它们的路易斯结构式。

该结构虽然各个原子均满足8电子稳定结构,但N的形式电荷为-1,S的形式电荷为+ 1,考虑到S为第三周期元素,可以将它周围电子修正为10e-,写成:
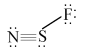
此时各原子形式电荷均为0,该结构更稳定。 在POCl3、SF6、XeO3等化合物中,中心原子的价电子较多,同时又有空的d轨道,形成共价键后,外围电子超过8e-,称为富电子化合物。例 如:
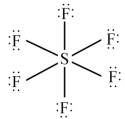
而BF3分子中,硼原子周围是6e-,未达到8e-,为缺电子化合物。其稳定的结构式为
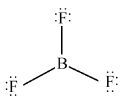
由上可知,路易斯结构八隅体存在例外情况, 例如奇电子化合物NO2,缺电子化合物BeCl2、 BF3,富电子化合物SF6、PCl5等。在书写时要多加注意。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。分析: 依据价层电子对数计算公式分析, 可得价层电子对数=5=[2+3],故有2个配位原子...
...
比较键角大小分析思路: 参照以下顺序来判断键角大小 ①先从中心原子的杂化类型来入手...
顺反异构中,分子的对称性、极性以及熔点和沸点存在以下差异: 1.对称性比较 反式异构...
01 — 概念 在多原子分子(就是三个或三个以上的原子构成的分子)中,如有相互平行的p...
含有共价键的物质中相邻两键之间的夹角称为键角。键角是决定物质分子空间构型的主要因...