
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、实验装置的连接与实验条件的控制
1.气体制备与性质实验装置的连接流程
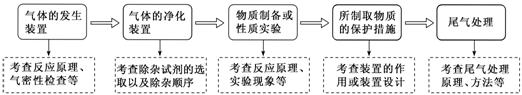
2.气体制备、净化与尾气处理中的三个“![]() ”
”
(1)牢记气体制备的3类发生装置
类型 | 固体+固体加热 | 固体+液体加热 | 固(或液)体+液体 不加热 |
装置 |
|
|
|
适用的 气体 | O2、NH3 | Cl2 | NO2、O2、NH3等 |
(2)掌握气体净化的3类装置
| 装置为加热固态试剂以除去气体中杂质的装置,为防止固体“流动”,两端用石棉或玻璃棉堵住,但要使气流通畅 |
| 装置一般盛液体试剂,用于洗气 |
| 装置一般盛固体试剂,用于气体除杂和定量计算 |
(3)掌握有毒尾气处理的3种方法
灼烧式 | 将有毒气体通过灼烧转化为无毒物质 |
|
收集式 | 将有毒气体收集到塑料袋或其他容器中 |
|
吸收式 | Cl2、SO2、NO2可用NaOH溶液吸收 |
|
NO:先通入空气,再用NaOH溶液吸收 | ||
H2S:用CuSO4溶液吸收 |
3.实验条件控制的操作与目的
条件控制是化学实验的重要手段,通过控制条件可以使反应向着实际需要的方向进行与转化。
(1)化学实验中温度控制的目的
①加热的目的:加快化学反应速率或使化学平衡向某方向移动。
②降温的目的:防止某物质在高温时分解或使化学平衡向某方向移动。
③控制温度在一定范围的目的:若温度过低,则反应速率(或溶解速率)较慢;若温度过高,则某物质(如H2O2、氨水、草酸、浓硝酸、铵盐等)会分解或挥发。
④水浴加热的好处:受热均匀,温度可控,且温度不超过100℃。
⑤冰水浴冷却的目的:防止某物质分解或挥发。
⑥趁热过滤的原因:保持过滤温度,防止温度降低后某物质析出。
⑦减压蒸发的原因:减压蒸发降低了蒸发温度,可以防止某物质分解(如浓缩双氧水需减压蒸发低浓度的双氧水溶液)。
(2)化学实验中控制气体流速的操作与目的
①H2还原金属氧化物(如CuO)的实验中,先通入一段时间H2的目的是排尽装置中的空气,防止加热时H2与O2混合发生爆炸。
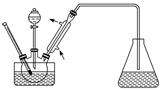
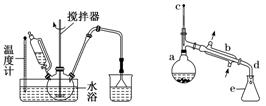
②测定某铁硫化物(FexSy)的组成实验如下图所示:
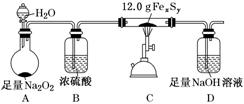
实验中通过控制滴加分液漏斗中水的流速来控制产生O2的流速,当实验结束后(即硬质试管中固体质量不再改变时),继续向烧瓶中滴加水,目的是利用产生的O2将装置中的SO2驱赶至D装置中,以保证反应产生的SO2被NaOH溶液完全吸收。
二、物质制备实验与定量测定实验
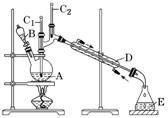
1.熟知物质制备实验的解题流程
分析制备流程 |
|
熟悉重要仪器 |
|
特殊实验装置分析 | ①制备在空气中易吸水、潮解以及水解的物质(如Al2S2、AlCl3等),往往在装置的末端再接一个干燥装置,以防止空气中水蒸气的进入。 ②用液体吸收气体,若气体溶解度较大,要加防倒吸装置。 ③若制备物易被空气中氧气氧化,应加排空气装置。 |
依据反应特点作答 | 加热操作:①使用可燃性气体(如:H2、CO、CH4等),先用原料气赶走系统内的空气,再点燃酒精灯加热,以防止爆炸。 ②制备一些易与空气中的成分发生反应的物质(如H2还原CuO的实验),反应结束时,应先熄灭酒精灯,继续通原料气至试管冷却。 有机制备:①有机物易挥发,反应中通常采用冷凝回流装置,以提高原料的利用率和产物的产率。 ②在实验中需要控制反应条件,以减少副反应的发生。 ③根据产品与杂质的性质特点,选择合适的分离提纯方法。 |
2.牢记有机物制备的典型装置
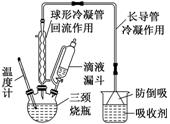
(1)反应装置
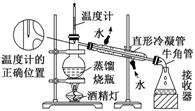
(2)蒸馏装置
(3)常见装置
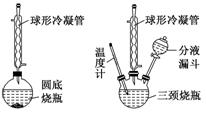
[提醒] 球形冷凝管由于气体与冷凝水接触时间长,具有较好的冷凝效果,但必须竖直放置,所以蒸馏装置必须用直形冷凝管。
3.明确定量测定实验中数据的获得与计算
(1)获得数据的典型方法——滴定法
①常用方法(以碘量法为例):
A.原理:
碘量法是氧化还原滴定中应用较为广泛的一种方法。I2可作氧化剂,能被Sn2+、H2S等还原剂还原;I-可作还原剂,能被IO![]() 、Cr2O
、Cr2O![]() 、MnO
、MnO![]() 等氧化剂氧化。碘量法分为直接碘量法和间接碘量法,直接碘量法是用碘滴定液直接滴定还原性物质的方法,在滴定过程中,I2被还原为I-。
等氧化剂氧化。碘量法分为直接碘量法和间接碘量法,直接碘量法是用碘滴定液直接滴定还原性物质的方法,在滴定过程中,I2被还原为I-。
B.应用:
高考试题中经常涉及的是间接碘量法(又称滴定碘法),它是利用I-的还原性与氧化性物质反应产生I2,遇淀粉溶液显蓝色,再加入Na2S2O3标准溶液与I2反应,滴定终点的现象为蓝色消失且半分钟内不变色,从而测出氧化性物质的含量。
例如用间接碘量法测定混合气中ClO2的含量,有关的离子方程式为2ClO2+10I-+8H+===2Cl-+5I2+4H2O和I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() ,得关系式2ClO2~5I2~10S2O
,得关系式2ClO2~5I2~10S2O![]() ,然后根据已知条件进行计算。
,然后根据已知条件进行计算。
②常见“滴定分析法”的定量关系
定量关系 | 反应原理 | |
凯氏定氮法 | n(N)=n(HCl) | NH3·H3BO3+HCl=NH4Cl+H3BO3 |
I2与S2O | 2n(I2)=n(S2O | 2S2O |
K2CrO4与AgNO3 | n(Ag+)=2n(CrO | 2Ag++CrO |
KMnO4与Na2C2O4 | 5n(KMnO4)=2n(Na2C2O4) | 2MnO |
KMnO4与H2O2 | 5n(KMnO4)=2n(H2O2) | 2MnO |
K2Cr2O7与Fe2+ | 6n(K2Cr2O7)=n(Fe2+) | Cr2O |
EDTA与金属阳离子(Mn+) | n(Y4-)=n(Mn+) | Mn++Y4-===MYn-4 |
(2)常见的计算方法
①关系式法
多步反应是多个反应连续发生,各反应物、生成物之间存在确定的物质的量关系,根据有关反应物、生成物之间物质的量的关系,找出已知物的量与未知物的量间的数量关系;列比例式求解,能简化计算过程。
②守恒法
所谓“守恒”就是物质在发生“变化”或两物质在发生“相互作用”的过程中某些物理量的总量保持“不变”。在化学变化中有各种各样的守恒,如质量守恒、原子守恒、得失电子守恒、电荷守恒等。根据守恒关系可列等式求解。
③计算公式
产品产率=![]() ×100%
×100%
反应物转化率=![]() ×100%
×100%
三、物质性质与物质组成探究实验
1.理清性质探究型实验题的解题思路
(1)巧审题,明确实验目的和原理。实验原理可从题给的化学情境(或题首所给实验目的)并结合元素化合物、化学实验基本操作、化学反应基本原理等有关知识获取。
(2)想过程,理清实验操作的先后顺序。根据实验原理所确定的实验方案中的实验过程,确定实验操作的方法、步骤,把握各步实验操作的要点,理清实验操作的先后顺序。
(3)看准图,分析各项实验装置的作用。在解答过程中,要认真细致地分析图中所示的各项装置,并结合实验目的和原理,确定它们在该实验中的作用。
(4)细分析,得出正确的实验结论。在分析实验现象(或数据)的过程中,要善于找出影响实验成败的关键以及产生误差的原因,或从有关数据中归纳出定量公式,绘制变化曲线等。
2.熟知常考的“十大实验设计”
实验目的 | 实验设计方案 | 说明 |
(1)证明CO2中含有CO | 先除尽CO2,再把气体通入加热的CuO中,若黑色固体变为红色,生成的气体能使澄清石灰水变浑浊,则证明原混合气体中含有CO | 先除尽CO2后再通入CuO中,黑色CuO变红色说明该气体具有还原性 |
(2)证明SO | 向混合液中加入足量的BaCl2溶液,将沉淀溶于足量的盐酸中,若沉淀部分溶解且有刺激性气味的气体生成,则证明原混合液中含有SO | 或加入盐酸生成能使品红溶液褪色的有刺激性气味的气体 |
(3)证明含有Fe3+的溶液中含有Fe2+ | 加入酸性高锰酸钾溶液,若高锰酸钾溶液褪色,则证明原混合液中含有Fe2+ | 不能用硫氰化钾溶液鉴别,且不能有Cl-干扰 |
(4)①证明草酸的酸性强于碳酸 ②证明草酸是二元酸 | ①向1 mol·L-1NaHCO3溶液中加入1 mol·L-1草酸,若产生大量气泡,则证明草酸的酸性强于碳酸 ②定量实验:用NaOH标准溶液滴定草酸溶液,消耗NaOH的物质的量为草酸的2倍,则说明草酸是二元酸 | ①强酸制弱酸 ②定量中和反应 |
(5)证明碳酸的酸性强于硅酸 | 把CO2通入硅酸钠溶液中,若出现白色沉淀,则说明碳酸的酸性强于硅酸 | 利用强酸制弱酸 |
(6)证明氯气的氧化性强于单质硫 | 把氯气通入硫化氢溶液中,若有淡黄色沉淀生成,则证明氯气的氧化性强于单质硫 | 氧化剂的氧化性强于氧化产物的氧化性 |
(7)证明H2C2O4是弱酸 | 测Na2C2O4溶液的pH,pH>7说明H2C2O4是弱酸;或将pH=1的H2C2O4溶液稀释10倍,pH<2说明H2C2O4是弱酸 | 弱酸存在电离平衡,弱酸阴离子存在水解平衡 |
(8)证明SO2中含有CO2 | 先把混合气体通入足量的高锰酸钾溶液中,再通入品红溶液不褪色,最后通入澄清石灰水中,若澄清石灰水变浑浊,说明含有CO2 | 品红溶液不褪色,说明不含有SO2,澄清石灰水变浑浊说明含有CO2 |
(9)证明多元弱酸的酸式盐电离程度与水解程度的相对大小(以NaHCO3、NaHSO3为例) | ①常温下,测量NaHCO3溶液的pH,①若pH>7,则说明HCO ②常温下,测量NaHSO3溶液的pH,若pH<7,则说明HSO | 多元弱酸酸式盐(HA-)水解呈碱性,HA-电离呈酸性,故通过测量溶液酸碱性来判断 |
(10)Ksp大小的比较(以AgCl、AgI为例) | ①向AgNO3稀溶液中滴加NaCl溶液至不再有白色沉淀生成,再向其中滴加相同浓度KI溶液产生黄色沉淀 ②向浓度均为0.1 mol·L-1的NaCl、NaI混合溶液中,滴加0.1 mol·L-1AgNO3溶液,先产生黄色沉淀 | ①沉淀转化的实质是Ksp小的沉淀转化成Ksp更小的沉淀,AgCl+I- ②向等浓度的NaCl、NaI溶液中加入Ag+,Ksp小的首先产生沉淀 |
3.明确探究实验设计的注意问题
(1)在离子检验、气体成分检验的过程中,要严格掌握检验的先后顺序,防止各成分检验过程中的相互干扰。
(2)若有水蒸气生成,先检验水蒸气,再检验其他成分,如C和浓H2SO4的反应,产物有SO2、CO2和H2O(g),通过实验可检验三种气体物质的存在,但SO2、CO2都要通过溶液进行检验,对检验H2O(g)有干扰。
(3)对于需要进行转化才能检验的成分,如CO的检验,要注意先检验CO中是否含有CO2,如果有CO2,应先除去CO2再对CO实施转化,最后再检验转化产物CO2,如HOC—COOH![]() CO2↑+CO↑+H2O↑中CO的检验。
CO2↑+CO↑+H2O↑中CO的检验。
(4)要重视试剂名称的描述,如有些试剂的准确描述为:无水硫酸铜、澄清石灰水、酸性高锰酸钾溶液、浓硫酸、饱和NaHCO3溶液、NaOH溶液等。此外还应注意某些仪器的规格。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。1. 【实验 1-1 】胶体制备 实验原理: 实验步骤: 将饱和 FeCl 3 溶液逐滴加入沸水中...
知识要点 1.表格实验分析的“三个角度” (1)可行性。实验原理是否科学合理,操作和装...
有机制备实验是一类以有机物的制备为载体, 综合考査学生基础实验知识和基本实验技能...
一、燃烧类现象 1.镁条在空气中燃烧:发出耀眼强光,放出大量的热,生成白烟同时生成...
...
以无机物质制备为载体的综合型实验 1.气体制备与性质实验装置的连接流程 2.有气体参...