
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
本次将给同学们复习整理铁及其化合物,由于涉及铁元素的多种价态物质,内容较为丰富。并且,价态间的物质变化涉及氧化还原反应,所以有关铁元素的物质间的相互转化也很重要。还有一点,氧化还原反应又与电化学紧密联系,包括铁的电化学腐蚀与防护,故同学们应当努力完成本次学习任务,将铁及其化合物的相关知识点掌握并加以运用。
就高考备考中,尤其关于铁的知识给同学们列出以下复习提纲:
1、概括为四大部分:
(1)铁的游离态——即铁单质
(2)铁的化合态——即铁的化合物(包括含铁元素的盐、碱、氧化物)
(3)铁在电化学中的考查
2、铁单质的五个方面:
(1)铁原子结构、基态铁原子、Fe2+、Fe3+价电子排布、晶体铁结构
(2)铁在周期表中的位置
(3)金属铁物理性质(色、态、密度、熔沸点、硬度、导热、导电)
(4)金属铁化学性质(金属性很强、失电子能力很强、还原性很强)
(5)金属铁的制备与用途
3、含铁元素的氧化物——氧化亚铁、四氧化三铁、三氧化二铁
4、含铁元素的碱——氢氧化亚铁、氢氧化铁
5、含铁元素的盐——亚铁盐(Fe2+)、铁盐(Fe3+)
6、钢铁的吸氧腐蚀与析氢腐蚀(电化学中另做文章,暂不提及)
7、延伸自学:晶体场理论与常见的含铁配合物
古代社会的铁器时代大约起始于公元前2000年,但最早发现和使用铁是来自外太空的陨铁。陨铁是铁和、钴等金属的混合物,含铁量较高。在埃及等一些文明古国所发现的最早的铁器都是由陨铁加工而成的,所以古埃及人把铁叫做“天石”。
铁是地壳中含量仅次于氧、硅和铝,排第四。在地壳中存在的单质铁是极为少见的,广泛以化合态出现,许多矿物由于含有铁化合物而呈现特有的颜色。铁的最重要矿物是氧化物和碳酸盐。其中铁含量最高的矿物是磁铁矿(Fe3O4),它是一种黑色有铁磁性的矿物,另外赤铁矿(Fe2O3)、菱铁矿(FeCO3)、黄铁矿(FeS2)等都是常见的含铁矿石。
单质Fe溶于一般的无机酸,在冷的浓硫酸、浓硝酸中钝化,非氧化性酸中得到Fe(II)。在酸性和中性条件下Fe2+不水解,但极易被氧化,需强酸性或加入单质Fe抗氧化。Fe(III)极易水解呈黄色,在pH=3左右沉淀完全。碱性条件用次氯酸钠等氧化剂氧化得到Fe(VI),高铁酸钾常用作净水剂。Fe(III)可以被很多还原剂还原,如Sn(II)、Ti(III)、Zn等;在冰醋酸中,FeCl3氧化苯偶姻得到二苯乙二酮。
在铁的配合物中,Fe(III)与硫氰根离子形成血红色络合物、与酚类形成蓝紫色或橙色络合物。赤血盐、黄血盐、滕氏蓝、普鲁士蓝四者的转化关系也是极为重要的,普鲁士蓝的结构与显色原因是此处的重中之重。
在工业上,铁是用铁矿石、焦炭和石灰石等在高炉中冶炼得到的。这样得到的铁叫做生铁。热分解五羰基合铁,用H2还原纯氧化铁,或电解纯铁盐水溶液可制得纯铁。(纯铁没有工业用途)。
铁是一种重要的黑色金属,人体必需的微量元素,科学家们早已发现铁是造血元素,是构成血肌红蛋白、红蛋白、细胞色素的主要成分。多吃猪肝等含铁食物可以补铁,另外告诉你,绿色蔬菜的铁含量较其他蔬菜高。
其实有些微量元素甚至对头发也有影响,如缺碘会使头发稀疏,却锌会产生掉发,缺铁会使毛发生长受阻,严重时会引起斑秃及大面积脱发。
自1889年蒙德(Ludwig Mond)和兰格尔(Carl Langer)发现了羰基镍,引起了科学家们的浓厚兴趣,1891年在实验室发明了羰基铁制备技术,1924年实现了工业化生产。羰基铁粉是目前能够采用工业化技术生产的粒度最细、纯度最高、球形外观最好的铁粉,属于高新技术产品,德国BASF拥有世界最大、最先进的羰基铁粉生产线,具有标准制定权和定价权,处于全球羰基铁粉市场垄断地位。
羰基铁粉是通过CO和铁在高温高压下反应,生成五羰基油状物Fe(CO)5,再热分解后得到的超细粉末。羰基铁粉呈洋葱球层状独特结构,具有良好的磁性能,用于制造导磁介电铁芯、高频磁芯和多种软磁材料元件。农业上,生产羰基铁爆硅藻土,用以改善酸性土壤。工业上羰基铁用作抗磨剂,添加小于0.1%的Fe(CO)5合成汽油,辛烷值从61提高到96,比苯增加了350倍,加入有机酸等用来降低Fe(CO)5添加剂对发动机汽缸的磨损,与四乙基铅汽油比较具有优势。另外,20世纪90年代以后对羰基铁粉微波吸收材料的研究非常迅速,目前,已大量使用于隐形飞机、隐形舰艇、导弹等军用产品的外表吸波涂层,是军事国防领域中的重要隐身材料。
今天我们就来好好认识一下铁及其化合物。
第一部分:金属铁
一、铁原子结构、基态铁原子、Fe2+、Fe3+价电子排布、晶体铁结构
1、基态铁原子核外电子排布
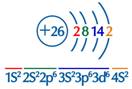
2、基态铁原子、Fe2+、Fe3+价电子排布
基态Fe:1s22s22p63s23p63d64s2,简写为[Ar]3d64s2
价电子排布为3d64s2。
价电子数:8
但是它没有相应的失去所有的价电子(8个)的最高氧化态,它的最高氧化态为+6。在通常条件下,铁主要以+2、+3氧化态存在。
3、金属铁晶体结构:体心立方与面心立方两种
二、铁在周期表中的位置、同位素、存在
1、铁在周期表中的位置
第四周期Ⅷ族,属d区元素,与CO、Ni称为铁系元素。
2、同位素
铁的天然同位素有54Fe、56Fe、57Fe、58Fe。其中丰度最高的是56Fe(91.66%);另外还有52Fe、55Fe、59Fe、60Fe、61Fe等一些人工合成的同位素。
3、存在
在自然界中,游离态的铁只能从陨石中找到,分布在地壳中的铁都以化合物的状态存在。
三、金属铁物理性质(色、态、密度、熔沸点、硬度、导热、导电)
银白色具有金属光泽的固体,熔、沸点高,密度7.8g/cm3,有良好的导热、导电和延展性,能被磁铁吸引。
四、金属铁化学性质
铁是一种黑色金属,主要的化学性质如下:
1、与非金属单质(如O2、Cl2、S)的反应
(1)与O2常温下在空气中发生缓慢氧化生成铁锈
(2)与O2点燃时:3Fe+2O2![]() Fe3O4
Fe3O4
(3)与Cl2点燃时:2Fe+3Cl2![]() 2FeCl3剧烈燃烧,生成大量红棕色的烟
2FeCl3剧烈燃烧,生成大量红棕色的烟
(4)与S点燃时:Fe+S![]() FeS
FeS
①铁分别与氯气和盐酸反应所得的产物中铁元素的价态不同,Fe与Cl2反应生成FeCl3,而Fe与盐酸反应生成FeCl2。
②铁在潮湿的空气中生成的铁锈的主要成分是Fe2O3,而铁在纯氧中燃烧的产物是Fe3O4。
③铁与硫蒸气反应生成的是FeS而不是Fe2S3;铁与碘蒸气反应生成的是FeI2而不是FeI3。
2、与水反应
常温下铁与水不反应,在高温条件下与水蒸气反应:
3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
3、与酸反应
(1)与非氧化性的酸(稀盐酸):Fe+2H+===Fe2++H2↑
(2)与氧化性酸(稀硝酸):Fe+NO3-+4H+=== Fe3++NO↑+2H2O
(3)常温下,遇冷的浓硫酸、浓硝酸钝化
①常温下,能用铁制容器盛放浓硫酸、浓硝酸的原因是二者能使铁发生“钝化”,而不是铁与浓硫酸、浓硝酸不反应。利用这一性质常用铁桶装运浓H2SO4、浓HNO3等化学试剂。
②铁可以溶于热的浓硫酸中:2Fe+6H2SO4(浓、热)===Fe2(SO4)3+3SO2↑+6H2O。
4、与某些盐反应
与CuSO4溶液反应:Fe+Cu2+=== Fe2++Cu
与FeCl3溶液反应:Fe+2Fe3+=== 3Fe2+
五、工业炼铁
(1)原料:铁矿石、焦炭、空气、石灰石。
(2)设备:炼铁高炉。
(3)主要反应
①还原剂的生成:C+O2  CO2,CO2+C
CO2,CO2+C 2CO;
2CO;
②铁的还原:Fe2O3+3CO  2Fe+3CO2;
2Fe+3CO2;
③造渣反应:CaCO3  CaO+CO2↑,CaO+SiO2
CaO+CO2↑,CaO+SiO2 CaSiO3。
CaSiO3。
六、金属铁的用途
1、冶炼钢等合金;
2、铝合金广泛应用于电讯器材、建筑设备以及汽车、飞机、宇航飞行器及生活用品的制造。
3、炼钢厂利用铝的亲氧性作脱氧剂。
第二部分:铁的化合物
一、铁的氧化物
化学式 | FeO | Fe2O3 | Fe3O4 |
俗名 | 铁红 | 磁性氧化铁 | |
颜色状态 | 黑色粉末 | 红棕色粉末 | 黑色粉末(有磁性) |
溶解性 | 难溶于水 | 难溶于水 | 难溶于水 |
铁的氧化态 | +2 | +3 | +2、+3 |
说明:
(1)FeO属NaCl型晶胞,但铁原子应占的位置没有占满,所以氧化亚铁有时写成Fe0·95O;
(2)天然Fe3O4有磁性,不溶于酸和碱,是电的良导体;
(3)经x射线结构研究证明:Fe3O4是一种铁酸盐。
二、铁的氢氧化物
化学式 | Fe(OH)2 | Fe(OH)3 |
颜色状态 | 白色固体 | 红褐色固体 |
与盐酸反应 | Fe(OH)2+2H+=Fe2++H2O | Fe(OH)3+3H+=Fe3++3H2O |
受热分解 | 2Fe(OH)3 | |
制法 | 可溶性亚铁盐与碱反应 Fe2++2OH-=Fe(OH)2↓ | 可溶性铁盐与碱反应 Fe3++3OH-=Fe(OH)3↓ |
两者的关系 | 空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为 4Fe(OH)2+O2+2H2O=4Fe(OH)3 | |
①FeO和Fe3O4与足量HNO3反应时,发生氧化还原反应,Fe2+被HNO3氧化生成Fe3+。
②Fe2O3和Fe3O4与足量HI反应时,发生氧化还原反应,Fe3+被I-还原生成Fe2+。
防止Fe(OH)2氧化的方法
(1)将配制溶液的蒸馏水煮沸,驱除溶液中的氧气。
(2)将盛有NaOH溶液的胶头滴管尖端插入试管的亚铁盐溶液底部,并慢慢挤出NaOH溶液。
(3)在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。
(4)在亚铁盐溶液上面加保护层,如苯、植物油等。
(5)用Fe作阳极,石墨作阴极,电解NaCl溶液,利用新产生的Fe2+与OH-反应制取。
三、含铁元素的盐——亚铁盐(Fe2+)与铁盐(Fe3+)
1、亚铁盐(Fe2+)
(1)Fe2+的氧化性和还原性
含有Fe2+的溶液呈浅绿色,Fe2+处于铁的中间价态,既有氧化性,又有还原性,其中以还原性为主,如:遇Br2、Cl2、H2O2、NO3-(H+)等均表现为还原性。
Fe2+的酸性溶液与H2O2反应的离子方程式:2Fe2++H2O2+2H+===2Fe3++2H2O。
(2)可水解
Fe(OH)2是弱碱,含Fe2+的盐(如硫酸亚铁)溶液呈酸性。配制硫酸亚铁溶液时常加少量硫酸抑制Fe2+的水解,加少量铁屑防止Fe2+被氧化。
2、铁盐(Fe3+)的性质及应用
(1)氧化性
含有Fe3+的溶液呈棕黄色,Fe3+处于铁的高价态,遇Fe、Cu、HI、H2S等均表现为氧化性。
①Fe3+与S2-、I-、HS-、SO32-等具有较强还原性离子不能大量共存。
②Fe3+可腐蚀印刷电路板上的铜箔,反应的离子方程式为
2Fe3++Cu===Cu2++2Fe2+。
(2)可水解
Fe(OH)3是很弱的碱,且溶度积很小,因而Fe3+极易水解,只能存在于酸性较强的溶液中。
①利用Fe3+易水解的性质,实验室可用FeCl3滴入沸水中制取氢氧化铁胶体,反应的化学方程式:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。
②利用Fe3+易水解的性质,工业上常用调节pH方法除去溶液中的铁离子。
③利用Fe3+易水解的性质,实验室配制氯化铁溶液,通常将氯化铁固体先溶于较浓的盐酸中,然后再稀释至所需浓度。
④Fe3+与HCO3-、AlO2-、CO32-、ClO-等水解呈碱性的离子不能大量共存。
3、含Fe2+、Fe3+的混合溶液中Fe3+、Fe2+的检验。
(1)Fe3+的检验
方法一:混合溶液![]() 溶液变红色,说明含有Fe3+;
溶液变红色,说明含有Fe3+;
方法二:混合溶液![]() 试纸变蓝色,说明含有Fe3+。
试纸变蓝色,说明含有Fe3+。
(2)Fe2+的检验
方法一:混合溶液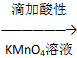 酸性KMnO4溶液紫红色褪去,说明含有Fe2+;
酸性KMnO4溶液紫红色褪去,说明含有Fe2+;
方法二:混合溶液![]() 溴水褪色,说明含有Fe2+;
溴水褪色,说明含有Fe2+;
方法三:混合溶液![]() 生成蓝色沉淀,说明含有Fe2+。
生成蓝色沉淀,说明含有Fe2+。
4、Fe2+、Fe3+检验时两大注意点
(1)检验Fe2+时不能先加氯水后加KSCN溶液,也不能将加KSCN后的混合溶液加入到足量的新制氯水中(新制氯水可能氧化SCN-)。
(2)Fe3+、Fe2+、Cl-同时存在时不能用酸性KMnO4溶液检验Fe2+(Cl-能还原酸性KMnO4,有干扰)。
5、混合液中Fe2+、Fe3+的除去方法
(1)除去Mg2+中混有的Fe3+的方法
向混合溶液中加入Mg、MgO、MgCO3、Mg(OH)2其中之一,与Fe3+水解产生的H+反应,促进Fe3+的水解,将Fe3+转化为Fe(OH)3沉淀而除去。
(2)除去Mg2+中混有的Fe2+的方法
先加入氧化剂(如H2O2)将溶液中的Fe2+氧化成Fe3+,然后再按(1)的方法除去溶液中的Fe3+。
四、“铁三角”转化
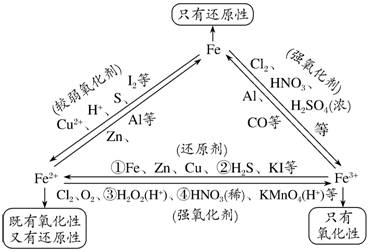
上述转化关系中标号反应的离子方程式:
①2Fe3++Fe===3Fe2+;
②2Fe3++H2S===2Fe2++S↓+2H+
③2Fe2++H2O2+2H+===2Fe3++2H2O;
④3Fe2++NO![]() +4H+===3Fe3++NO↑+2H2O
+4H+===3Fe3++NO↑+2H2O
第三部分:重要化合物
一、三氯化铁
在+3氧化态的盐中,最重要的是FeCl3·6H2O。它具有低熔、沸点,易挥发,易溶于乙醇、甘油、乙醚、丙酮等有机溶剂的特点,明显地具有共价性,可以使蛋白质聚沉,故可作为止血剂。
三氯化铁在酸性溶液中具有一定的氧化性,属中强氧化剂,例如印刷电路的制版过程中,将粘有铜箔的胶木板先制成薄膜线路,再将其浸入FeCl3(aq)中进行腐蚀得到。Fe3+还能把I-、Sn2+、H2S和SO2分别氧化成I2、Sn4+、S、SO42-。
二、黄血盐与赤血盐
黄血盐 | 赤血盐 | |
化学式 | K4[Fe(CN)6] | K3[Fe(CN)6] |
名称 | 六氰合铁(Ⅱ)酸钾、亚铁氰化钾 | 六氰合铁(Ⅲ)酸钾、铁氰化钾 |
铁元素化合价 | +2 | +3 |
色、态 | 黄色晶体 | 红色晶体 |
应用 | 鉴定Fe3+(生成普鲁士蓝沉淀) | 鉴定Fe2+(生成滕氏蓝沉淀) |
备注 | 相比剧毒物氰化钠,黄血盐与赤血盐属于低毒物,但与酸情况下,会释放出剧毒的氢氰酸,使用时需格外小心! | |
小科普:亚铁氰化钾别名黄血盐(Potassium Ferrocyanide),为鲜黄色单斜体晶体或粉末,无臭,略有咸味,具有抗结性能,可用于防止细粉、结晶性食品板结。例如,食盐长久堆放易发生板结,加入亚铁氰化钾后食盐的正六面体结晶转变为星状结晶,从而不易发生结块。
我国的盐中多数盐品都未添加亚铁氰化钾,只有井矿盐等容易结块的盐添加了亚铁氰化钾作为抗结剂!K4[Fe(CN)6]里面的氰根(CN-)和铁是牢牢结合在一起的(形成配位键),所以它的急性毒性比氰化钾(KCN)差了几百倍,所以亚铁氰化钾是合法的食品添加剂,用作抗结剂。
另外亚铁氰化钾在高温下可以分解产生氰化钾,但这个温度至少要400℃,我们平时的烹饪根本达不到这个温度(不粘锅越330℃时其涂层就开始熔化了),最后再告诉你一点,假设亚铁氰化钾全部诡异般的分解,那也需要一次性吃几十斤的食盐才会致命。
所以亚铁氰化钾的安全性是有保障的,适当吃盐根本不用担心。
三、血红蛋白
微量元素在人体内含量极少,但具有重要的生理功能。如铁与血有密切关系,铁在人体内的主要功能是以血红蛋白的形式参加氧的转运、交换和组织呼吸过程,此外,铁还与许多酶的合成有关,如果体内缺铁,会造成缺铁性或营养性贫血。
铁的供给量标准:成年男性每日12mg,成年女子18 mg,孕妇和乳母28 mg,青少年15~20mg,儿童10~12mg。
含铁质丰富的食物:动物肝脏、蛋黄、豆类和一些蔬菜(如紫菜、黄花菜和黑木耳)等。
下面给诸位补一补生物,呵呵呵~~~~
为什么血液是红色的?因为血液里含有红细胞,红细胞是红色的。
红细胞为什么是红色的?因为红细胞中有一种蛋白质——血红蛋白,它是红色的。
血红蛋白为什么是红色的?因为血红蛋白里含有铁元素,易被氧化形成红色的氧化铁,所以我们的血液才是红色的。
现在你能理解铁是血液的核心元素了吧。
四、二茂铁
铁的一个重要配位化合物是环戊二烯基配位化合物Fe(C5H5)2,称为二(环戊二烯基)合铁(Ⅱ),俗称二茂铁,橙黄色固体,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂。熔点为446K,但在373即发生升华,是典型的共价化合物。
二茂铁中铁的氧化态为+2,Fe2+具有空轨道,与C5H5-形成的多中心π键配合物。
二茂铁是燃料油的添加剂,用以提高燃烧的效率和去烟,它还可以做导弹和卫星的涂料及高温润滑剂等。
可以说,二茂铁是有机金属化学发展的一个里程碑。1950年两个研究小组几乎同时用不同的方法合成出二茂铁。二茂铁的出现立即引起了人们的广泛关注,这类化合物的合成及表征立即成为化学研究的热点,各种金属的夹心化合物及其衍生物层出不穷。由于对这个夹心结构的表征及其后来在这个领域研究的杰出贡献,Wilkinson和Fischer共享了1973年的诺贝尔化学奖。
五、羰基铁 Fe(CO)5
1824年,巴斯夫发明了用于电话感应线圈和超细羰基铁粉末,并且成功地将这种电磁性优异的材料用于后来风靡全球的录音磁带,极大程度地丰富了家庭晚间娱乐生活。
来自巴斯夫存储媒体时代的一种产品,至今仍活跃在消费电子产品领域——羟基铁粉。它能保护手机等设备的敏感电子元件,在变化的磁场和温度下持续可靠地提供稳定的直流电。
在羰基铁中,Fe的氧化态为0,价电子构型3d64s2,价电子数为8。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。鲍林在研究含氧酸时,将其化学式一般写作 HRO,其中 R 代表中心原子,羟基(–OH)与...
...
一、银47Ag 银亲硫,极化能力强。在自然界中常以自然银、硫化物等形式存在,因其离子...
一、镓Ga 从铝土矿Al 2 O 3 或闪锌矿Zns的冶炼过程中提取,最后经电解制得纯净镓。 门...
一、铁 Fe 古代社会铁器时代大约起始于 前 2000 年 ,最早发现和使用的铁是来自外空的...
一、钪Sc 1、单质是柔软、银白色。熔点1500℃以上。钪常用来制特种玻璃、轻质耐高温合...