
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
就“钠及其化合物”在基础备考点上给同学们列出以下复习提纲:
1、概括为三大部分:钠的游离态——即钠单质、钠的化合态——即钠的化合物(包括含钠元素的碱、盐、氧化物)和碱金属的周期性变化及特殊性
2、钠单质的六个方面:
(1)钠原子结构、基态钠原子(钠离子)价电子排布、晶体钠结构(体心立方)
(2)钠在周期表中的位置、原子半径、离子半径、电离能
(3)金属钠物理性质(色、态、密度、熔沸点、硬度、导热、导电)
(4)金属钠化学性质(金属性很强、失电子能力很强、还原性很强)
(5)金属钠的用途
(6)金属钠的制备与保存
3、含钠元素的碱——氢氧化钠
4、含钠元素的盐——Na+
5、含钠元素的氧化物——氧化钠与过氧化钠
(1)比较学习氧化钠与过氧化钠(组成、化学键成分、氧原子的氧化态、性质)
(2)过氧化钠的强氧化性、漂白性
6、延伸学习(一):焰色反应
7、延伸学习(二):海水晒盐
8、延伸学习(三):生活中的“钠”些物质
钠在生活中的用途很多,比如:调味剂——食盐(NaCl)、味精(谷氨酸钠);着色剂——亮蓝;防腐剂——苯甲酸钠;滴眼液——羧甲基纤维素钠;漂白剂——次氯酸钠;肥皂——高级脂肪酸钠等等,都是含钠元素的物质。
可以说钠是刺激我们味蕾的元素,可它也是高血压的养成元素。钠是人体最重要的矿物质之一。世界卫生组织推荐每人每天钠的摄入量是5克。1957年,丹麦Aarhus大学Sou发现了Na+/K+-ATP酶,该酶的作用是作为膜表面的生物泵,用来维持细胞内外的离子梯度,获得了1997年诺贝尔化学奖。
今天我们就来好好认识一下钠和它所在的碱金属。
钠在地壳中含量排第七位,在其后面就是钾,尽管钠和钾在地壳中含量几乎相同,但在海洋中钠的含量几乎是钾的30倍,所以海水是咸的哦!人们可以通过海水获得食盐的主要成分之一——氯化钠(NaCl)。
其实,人类和钠打交道已经有几千年的历史。很久以前就知道食盐可以吃,是人类最早进行贸易的商品之一。食盐曾经作为货币流通。“圣经”上记载过人们为争夺食盐而发生的战争。在现代无机化学工业中氯化钠的使用比任何其他原料都多(只有磷酸盐矿与它接近)。
英国科学家戴维在29岁(1807年)通过电解熔融的苛性钾(KOH)分离出金属钾的惊人成就早已为人熟知,几天之后,他又由熔融的苛性钠同样地得到了熔融的钠珠。由于钠的反应活性很强,早期通过水溶液的方式获得钠就没有成功。Dvy将钾、钠分贝命名为Potassium和Sodium,因钾是从草木灰(Potash),钠是从天然碱苏打(SDA)中得到而得名。1907年,人们还为戴维召开一百周年纪念会。金属钠在现代工业上是用电解熔融的NaCl和CaCl2的低共熔混合物得到的。
金属钾、钠的问世曾引起轰动,因为在当时人们的印象中,金属的密度应该比水大,入水能沉,并且很软,只有在烈火中才能熔化。而钠却像蜡一样软,可以用小刀轻轻切开还可以浮在水面上,并且一秒种也不安静,到处窜来窜去,发出嘶嘶的声音并扬起白烟,变得越来越小,最后完全消失。即使在冰面上,钠也能自行燃烧,后来的研究表明,金属钠在-80℃时就可与水反应,可见钠的还原能力远远超过了氢。在煤油里,它会平静地呆在里面,但如果把它暴露在空气中,马上会失去银白色的光泽而披上一层薄膜。钠还能同卤族元素氟、氯、溴、碘以及硫、磷、氮等元素直接反应,也可以与氯化氢、氨等化合物发生反应。
金属钠的工业应用与其强还原性有关。世界产量约20%的金属钠可用于还原相应的氯化物生产钛、锆等金属,约10%的金属钠用于生产钠的化合物(如NaH、NaOH、Na2O2)。
所有的碱金属都具有特征的火焰颜色,这是由于其最外层电子容易被激发,可以借助其火焰光谱或原子吸收光谱进行分析测定。
第一部分:金属钠
一、钠原子结构、基态钠原子(钠离子)价电子排布、晶体钠结构(体心立方)
1、钠原子(及钠离子)结构
![]()
由此我们可以看出,钠的最外层电子数为1,极易失去最外层上的一个电子,化学性质极为活泼,常见化合价为+1价
2、钠原子(及钠离子)的(价)电子排布
基态Na:1s22s22p63s1,简写为[Ne]3s1,价电子排布为3s1。
轨道表达式为:
3、金属钠晶体结构:体心立方堆积

二、钠在周期表中的位置、原子半径、离子半径、电离能
1、钠在周期表中的位置
第三周期ⅠA族,属s区元素,与Li、K、Rb、Cs、Fr称为碱金属。
2、原子(离子)半径
Na是第三周期(Ar除外)半径最大的原子,也是短周期主族元素中最大的原子。
但Na+非第三周期半径最大的简单离子,只能说Na+是第三周期半径最大的阳离子。
三、金属钠物理性质(色、态、密度、熔沸点、硬度、导热、导电)
银白色固体,有金属光泽,质地软,熔点低(<100℃),密度比水小,比煤油大,具有导电和导热性。
四、金属钠化学性质——强还原性
![]()
1、与非金属单质(如O2、Cl2)的反应
O2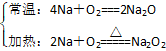
Cl2:2Na+Cl2![]() 2NaCl
2NaCl
2、与水反应
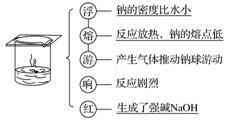
离子方程式:2Na+2H2O===2Na++2OH-+H2↑
与滴加酚酞的水反应的现象及解释
3、与盐酸反应
离子方程式:2Na+2H+===2Na++H2↑
4、与盐反应
(1)钠与盐溶液反应
![]()
![]()
![]()
![]()
![]()
如Na投入CuSO4溶液中,反应的离子方程式为
2Na+2H2O+Cu2+===2Na++Cu(OH)2↓+H2↑。
(2)钠与熔融盐反应:
4Na+TiCl4![]() Ti+4NaCl
Ti+4NaCl
五、金属钠的用途
1、钠、钾合金(液态)可用于原子反应堆的导热剂;
2、金属钠还可用于钛、锆、铌、钽等金属的冶炼。
3、用作电光源,制作高压钠灯。
六、金属钠的制备
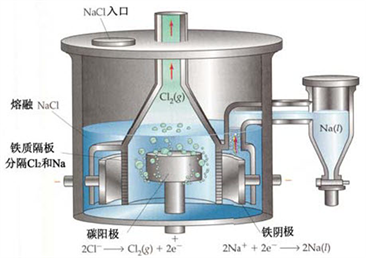
电解熔融的NaCl和CaCl2的低共熔混合物得到的
2NaCl(熔融)![]() 2Na+Cl2↑
2Na+Cl2↑
七、金属钠的保存
密封保存,通常保存在石蜡油或煤油中。

第二部分:氧化钠与过氧化钠
用比较法从物质颜色、状态、氧化物类型、氧元素氧化态、化合物电子式、化学键类型、何种条件下生成、化学性质比较。
重点掌握过氧化钠以下四点:
1、Na2O中只有离子键,而Na2O2中既有离子键,又有共价键。
2、Na2O2晶体中阴、阳离子个数比为1∶2而不是1∶1。
3、Na2O2与水、CO2反应都是自身的氧化还原反应。
4、Na2O2的强氧化性与还原性
5、过氧化钠粉末呈黄色,易吸潮,与水或稀酸作用生成过氧化氢,所生成的过氧化氢立即分解出氧气,故过氧化钠被广泛地用作氧气发生剂和漂白剂。
第三部分:焰色反应
一、焰色反应的概念
很多金属或它们的化合物在灼烧时都会使火焰呈现特殊颜色的现象。
二、焰色反应的原理
以钠的焰色过程为例,对于蘸有NaCl的铂丝,经脱水、蒸发、分解等物理化学变化形成基态Na,基态Na被热能激发,激发后的Na原子的最外层电子吸收一定的能量而离开了原来的能级,跃迁到了能量较高的能级上,处在能量较高能级的这个电子是不稳定的,又跃迁回到了基态或低能态,对于不同的原子在经历上述过程中会产生不同波长的辐射,从而得到不同的焰色反应。
三、焰色反应的实验操作
铂丝![]() 无色
无色![]() 待测物
待测物![]() 观察火焰颜色
观察火焰颜色![]() 铂丝
铂丝![]() 无色。
无色。
四、常见元素的焰色反应

锂Li红色、钠Na黄色、钾K紫红色、铷Rb紫色、铯Cs天蓝色,上图从左至右分别为碱金属元素的焰色反应。
| 钙Ca | 锶Sr | 钡Ba |
砖红色 | 洋红色 | 绿色 | |
左图从左至右分别为钙、锶钡、焰色反应。 | |||
五、再说焰色反应
1、“焰色反应”的最先发现者应是中国的陶弘景。1400多年前陶弘景利用它来鉴别消石(KNO3)和朴消(Na2SO4)。
2、现行的高校无机化学教程中提到常用焰色反应对硼的化合物进行定性检验。即某些非金属也具有此性质。
3、焰色反应是由于金属或者金属化合物在火焰灼烧时原子发生能级跃迁而发射了具有特征颜色的光。在整个实验过程中只改变了原子的能级状态,并没有产生新的物质,即焰色反应不是化学反应。
第四部分:生活中的“钠”些物质

1、膨松剂——碳酸氢钠
2、调味剂——氯化钠、谷氨酸钠
3、防腐剂——苯甲酸钠
4、滴眼液——羧甲基纤维素钠
5、漂白剂——次氯酸钠
6、肥皂——高级脂肪酸钠
7、钠离子电池
第五部分:碱金属
一、碱金属的结构特点
位于周期表的s区、ⅠA。价层电子结构:ns1;。
ⅠA元素它们均很容易失去1e-→M+(M+具有8e-稳定结构,所以不易再失去电子,结合第二电离能I2很高可以看出。)
金属活泼性从上到下增强(因为原子半径从上到下增大,电离能,电负性从上到下减小)。
二、碱金属单质的性质
1、有金属光泽、密度小、硬度小、熔点低(由于碱金属原子只有一个价电子且原子半径较大,故金属键很弱,熔沸点较低)、导电、导热性好。熔点变化如图所示。

2、均质地较软、可用刀切割。
3、Li、Na、K密度小于1(实验室Li保存在石蜡中,Na、K保存在煤油中),其中锂是所有金属中密度最小的。
4、ⅠA金属能形成液态合金:例:Na-Hg齐合金是一种温和的还原剂;Na-K合金,比热高,被用于核反应堆的冷却剂。
5、单质的化学性质
(1)与氧、硫、氮、卤素等非金属反应,形成相应的化合物。其中Li是唯一可以与N2反应反应的碱金属。
(2)与水剧烈反应:2M+2H2O→2MOH+H2(g)

上图所示依次为Li、Na、K单质与H2O反应。(从左至右)
三、碱金属的用途
1、锂
(1)制造氢化锂、合成有机锂化合物,后者用做有机化学中的还原剂和催化剂;
(2)制造高功率长效电池(用于手表、计算机、心脏起搏器等)。
2、钠
(1)作为还原剂制造某些难熔的金属如铀、钍、锆等,特别是还原制备钛;
(2)因具有高的导热性和低的中子吸收能力,被用做快速增殖反应堆的冷剂;
(3)制作钠电缆、钠基电池和钠硫电池等。
3、钾
钠钾合金用做核反应堆的冷却剂。
四、电解法制备钠
电解法制备钠装置

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。元素种类 对应物质的常考易错点 N 性质:(1)浓HNO 3 和Cu(足量)在反应时,随反应进行...
例题1:浓硫酸与金属反应的条件 题目:常温下,浓硫酸能否与金属铁发生反应? 错误答...
鲍林在研究含氧酸时,将其化学式一般写作 HRO,其中 R 代表中心原子,羟基(–OH)与...
...
一、银47Ag 银亲硫,极化能力强。在自然界中常以自然银、硫化物等形式存在,因其离子...
一、镓Ga 从铝土矿Al 2 O 3 或闪锌矿Zns的冶炼过程中提取,最后经电解制得纯净镓。 门...