
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
就高考备考中,尤其关于镁的知识给同学们列出以下复习提纲:
1、概括为三大部分:镁的游离态——即镁单质、镁的化合态——即镁的化合物(包括含镁元素的碱、盐、氧化物)和碱土金属的周期性变化及特殊性
2、镁单质的六个方面:
(1)镁原子结构、基态镁原子(镁离子)价电子排布、晶体镁结构(六方最密)
(2)镁在周期表中的位置、原子半径、离子半径、电离能的变化
(3)金属镁物理性质(色、态、密度、熔沸点、硬度、导热、导电)
(4)金属镁化学性质(金属性很强、失电子能力很强、还原性很强)
(5)金属镁的用途
(6)金属镁的制备
3、含镁元素的碱——氢氧化镁
4、含镁元素的盐——碳酸镁
5、含镁元素的氧化物——氧化镁
6、海水提镁
碱土金属指ⅡA族的所有元素,包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)、镭(Ra)六种,其中镭为放射性元素,由玛丽·居里(M.Curie)和皮埃尔·居里(P.Curie)在沥青矿中发现。
碱土金属中除铍外都是典型的金属元素,氧化态为+2,其单质为灰色至银白色金属,硬度比碱金属略大,导电、导热能力好,容易同空气中的氧气和水蒸气作用,在表面形成氧化物和碳酸盐,失去光泽。碱土金属的氧化物熔点较高,溶于水显较强的碱性,其盐类中除铍外,皆为离子晶体,但溶解度较小。在自然界中,碱土金属都以化合物的形式存在,可用焰色反应鉴定。
1808年,英国化学家Dvy以汞为阴极电解汞和氧化镁的混合物,得到镁汞齐。1828年,法国化学家Bussy将无水氯化镁和金属钾同时溶解,首次分离出纯的金属镁。因为镁矿石产于希腊的美格尼西亚(Magnesia),故镁的英文名为Magnesium。
金属镁与战争有着密切的关系,镁最重要的用途就是用来制造合金,最常见的是镁铝合金,它含有5%~30%的镁,镁铝合金比纯铝更坚硬,强度更大,而且比纯铝更易于飞机制造行业,能够满足航空航天等高科技领域对材料吸噪、减震、防辐射的要求,因此被称为“国防金属”,可以说镁是高科技武器必不可少的材料。
镁在空气中易于氧结合燃烧发出强光,利用这一点国防上制造照明弹、燃烧弹;摄影上用于闪光灯。
镁与钾、钙一样,是地壳中部分最广的元素之一。镁不是以单质状态存在,而是作为盐类或岩石在自然界大量分布,镁的主要矿物有白云石CaCO3·MgCO3,光卤石KCl·MgCl2·6H2O等。
海水中约含有0.13%的镁,镁也存在于植物中,是叶绿素的主要成分。镁还存在于人体细胞中。它对蛋白质、核酸、类脂化合物的酶合成的活化,软骨和骨的生长以及维持脑和甲状腺机能非常重要。镁以磷酸盐、碳酸盐形式分布于股和肌肉中,缺乏镁会引起肌肉的颤动、脉象的混乱。
今天我们就来好好认识一下镁和它所在的碱土金属。
第一部分:金属镁
一、镁原子结构、基态镁原子(镁离子)价电子排布、晶体镁结构(六方最密)
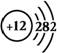
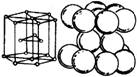
1、镁原子(及镁离子)结构
由此我们可以看出,钠的最外层电子数为2,极易失去最外层上的2个电子,化学性质极为活泼,常见化合价为+2价
2、镁原子(及镁离子)的(价)电子排布
基态Mg:1s22s22p63s2,简写为[Ne]3s2,价电子排布为3s2。
轨道表达式如图

3、金属镁晶体结构:六方最密堆积
二、镁在周期表中的位置、同位素
1、镁在周期表中的位置
第三周期ⅡA族,属s区元素,与Be、Ca、Sr、Ba、Ra称为碱土金属。
镁是碱土金属中最稳定的元素。
2、同位素
镁的稳定同位素有24Mg、25Mg、26Mg;其自然丰度分别为78.70%、10.13%、11.17%。
在天然存在的某种元素里,不论游离态还是化合态,各种同位素原子百分比称为该元素的自然丰度。
三、金属钠物理性质(色、态、密度、熔沸点、硬度、导热、导电)
银白色固体,有金属光泽,密度、硬度均很小,是一种重要的轻金属。熔点649℃,具有良好的导热、导电和延展性。
四、金属镁化学性质——强还原性
通常情况下,镁是灰白色的,其表面有一层氧化膜,常温下,迅速溶于稀酸,并在乙醚溶液中被许多烃基和芳基卤化物所侵蚀而成格式试剂。
从镁的电负性(1.31)和标准电极电势(-2.36V)看,它是一种活泼的金属,主要的化学性质如下:
1、与大多数非金属单质(如O2、N2、S、X2)的反应
O2:2Mg+O2![]() 2MgO(耀眼的白光)
2MgO(耀眼的白光)
N2:3Mg+N2![]() Mg3N2(耀眼的白光)
Mg3N2(耀眼的白光)
Mg3N2能与水剧烈反应生成Mg(OH)2沉淀,放出氨气,所以只能在干态下制取。
Cl2:Mg+Cl2![]() MgCl2
MgCl2
S:Mg+S![]() MgS
MgS
2、与二氧化碳反应
CO2:2Mg(s)+CO2(g)![]() 2MgO(s)+C(s)
2MgO(s)+C(s)
现象:镁剧烈燃烧,发生强烈的白光,同时生成白色固体和黑色颗粒状固体
3、与热水(或水蒸气)反应
由于镁易形成氧化膜,故镁与冷水几乎不反应,但镁能与热水反应
Mg+2H2O![]() Mg(OH)2+H2↑
Mg(OH)2+H2↑
4、与大多数酸(HF、铬酸除外)反应
离子方程式:Mg+2H+===Mg2++H2↑
5、与卤代烃的醚溶液中形成格式试剂(在有机合成中应用广泛)
Mg+RX===RMgX
五、电解法制备镁
生产镁的最好方法是电解熔融卤化物混合物(如MgCl2+CaCl2+NaCl),镁沉积在阴极。
工业上一般不用电解氧化镁的方法制取镁,其主要原因有以下两点:
①MgO的资源低于MgCl2;②MgO的熔点(2200℃)高于氯化镁(714℃),浪费能源。
六、金属镁的用途
1、生产合金,特别是镁铝合金。
2、冶金工业上用作还原剂和脱氧剂。
3、利用镁牺牲阳极进行阴极保护:广泛应用于石油、天然气管道和锅炉设备等的腐蚀防护。
4、用于有机合成。
第二部分:镁及其化合物
一、氧化镁
MgO可由煅烧碳酸盐迅速得到,是一种白色粉末,属NaCl晶型,晶格能3795KJ·mol-1。MgO熔点很高(2642℃),可作耐火材料。
二、氢氧化镁
氢氧化镁是白色固体,易吸水潮解,难溶于水,Ksp=1.2×10-11,易溶于酸、铵盐溶液,
属中强碱。具有层状结构,层与层之间通过范德华力相互联系。
1、与酸反应
Mg(OH)2+2H+===Mg2++H2O
2、与铵盐(NH4+)反应
Mg(OH)2+2NH4+===Mg2++2NH3·H2O
第三部分:碱土金属的焰色反应
| 钙Ca | 锶Sr | 钡Ba |
砖红色 | 洋红色 | 绿色 | |
左图从左至右分别为钙、锶钡、焰色反应。 | |||
第四部分:生活中的“镁”些物质
1、运动员——涂“镁粉”(碳酸镁):增大掌心与器械之间的摩擦力
2、魔术师——镁粉真奇妙
第五部分:海水提镁
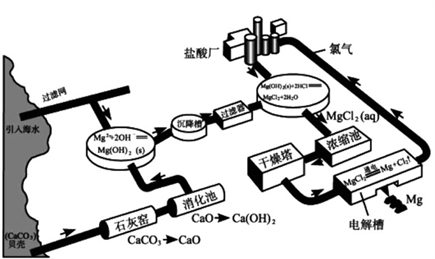
海水中镁的含量较为丰富,含镁约0.13%,每年从海水中生产1亿吨金属镁,经过100万年海水中镁的浓度也不过减少0.01%。目前世界60%的镁是从海水中提取的。
工业上提镁的一种方式是将海水抽入反应槽,加入石灰乳,使镁转换为Mg(OH)2沉淀,再加入盐酸转换为MgCl2溶液,蒸发溶液后,得到MgCl2·6H2O晶体,随后在HCl气流中脱水,得无水MgCl2,最后电解MgCl2得到Mg和Cl2,氯气可用来制盐酸,再循环利用。
注意:①由MgCl2•6H2O到无水MgCl2,必须在干燥HCl气流(必要时可加入脱水剂)中加热,以防MgCl2水解生成碱式氯化镁Mg(OH)Cl。
②因镁在高温下能与O2、N2、CO2等气体发生反应,故工业电解MgCl2得到的镁,应在H2氛围中冷却。
③氯化镁易潮解,普通食盐的潮解就是因含有氯化镁之故。
关于海水提镁,比较重要的是最后的电解过程,可能会考到,还有氯气的重复利用,体现了绿色化学的宗旨,也是一个考点。
第六部分:碱土金属
一、碱土金属的概述
碱土金属包括铍、镁、钙、锶、钡和镭六种元素,构成周期表Ⅱa族。由于钙、锶、钡的氧化物在性质上介于“碱性的”和“土性的”(既难溶于水又难熔融的Al2O3称为“土”)之间,所以这几种元素又称为碱土金属,现习惯上把铍、镁也包括在内。
在碱土金属中,铍是稀有元素,镁、钙、锶、钡是自然界中十分丰富的元素。镭是存在于铀矿石中的放射性元素。
二、碱土金属的结构特点
位于周期表的s区、ⅡA。价层电子结构:ns2;。
它们均很容易失去2e-→M2+
由于比相邻的ⅠA族元素的原子增加一个核电荷,因而原子核对最外层电子的引力增加了,结果他们的原子半径比同周期碱金属的小,失去一个电子也就比相应的碱金属困难(可以比较他们的第一电离能I1而得到证明。)
金属活泼性从上到下增强(因为原子半径从上到下增大,电离能,电负性从上到下减小)。
三、碱土金属的物理性质
1、碱土金属的单质为银白色(铍为灰色)固体,容易与空气中的氧气和水蒸气作用,在表面形成氧化物和碳酸盐,失去光泽而变暗。它们的原子有两个价电子,形成的金属键较强,熔、沸点较相应的碱金属要高。单质的还原性随着核电荷数的递增而增强。
2、碱土金属的硬度略大于碱金属,除铍和镁外,其他均可用刀子切割,新切出的断面有银白色光泽,但在空气中迅速变暗。其熔点和密度也都大于碱金属,但仍属于轻金属。
3、碱土金属的导电性和导热性能较好。
四、碱金属的化学性质
1、碱土金属最外电子层上有两个价电子,易失去而呈现+2价,是化学活泼性较强的金属,能与大多数的非金属反应,所生成的盐多半很稳定,遇热不易分解,在室温下也不发生水解反应。
2、它们与其他元素化合时,一般生成离子型的化合物。但Be2+和Mg2+离子具有较小的离子半径,在一定程度上容易形成共价键的化合物。钙、锶、钡和镭及其化合物的化学性质,随着它们原子序数的递增而有规律地变化。
3、碱土金属的离子为无色的,其盐类大多是白色固体,和碱金属的盐不同,碱土金属的盐类(如硫酸盐、碳酸盐等)溶解度都比较小。
4、碱土金属在空气中加热时,发生燃烧,产生光耀夺目的火光,形成氧化物。
5、碱土金属在高温火焰中燃烧产生的特征颜色,可用于这些元素的鉴定。
6、碱土金属与水作用时,放出氢气,生成氢氧化物,碱性比碱金属的氢氧化物弱,但钙、锶、钡、镭的氢氧化物仍属强碱。铍表面生成致密的氧化膜,在空气个不易被氧化,跟水也不反应。镁跟热水反应,钙、锶和钡易与冷水反应。钙、锶和钡也能与氢气反应。在空气中,镁表面生成一薄层氧化膜,这层氧化物致密而坚硬,对内部的镁有保护作用,所以有抗腐蚀性能,可以保存在干燥的空气里。钙、锶、钡等更易被氧化,生成的氧化物疏松,内部的金属会继续被氧化,所以钙、锶、钡等金属要密封保存。
五、碱土金属的用途
1、镁
镁的密度约为铝的2/3,在实际应用的金属中是最轻的。镁合金的吸振能力强、切削性能好、金属镁铸造性能好,很适合铸造汽车零件。
镁在人体新陈代谢过程中的作用举足轻重,是人体一切生长过程,如骨骼、细胞、核糖核酸、脱氧核糖核酸、心脏及各种生物膜形成的重要物质。
镁是叶绿素分子的组成成份,存在于叶绿素分子红构的卟啉环中间,叶绿素A和叶绿素B含镁量约2.7%,供镁不足会致使叶绿素减少叶片发黄,直接影响光合作用的效率。
2、钙
(1)CaCl2·6H2O加热脱水形成白色多孔的CaCl2。无水CaCl2有很强的吸水性,常用作干燥剂,由于它能与气态NH3和乙醇形成加合物,所以不能用于干燥氨气和酒精;
(2)次氯酸钙Ca(ClO)2可用作漂白剂;
(3)CaF2俗称萤石,是制备HF和F2的重要原料,萤石具有能降低难熔物质熔点,促进流动,广泛应用于冶金工业。
(4)CaSO4·2H2O俗称生石膏,加热至393K时,部分脱水形成熟石膏2CaSO4·H2O,该过程不可逆。熟石膏应用于模型、粉笔、石膏绷带、水泥等的生产。
3、钡
(1)Be盐和可溶性钡盐有毒;
(2)BaSO4俗称重晶石,可做白色涂料和添加剂。难溶于水,被用作“钡餐进行胃部X射线检查。
(3)过氧化钡常用于爆破作业中作强火剂。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。元素种类 对应物质的常考易错点 N 性质:(1)浓HNO 3 和Cu(足量)在反应时,随反应进行...
例题1:浓硫酸与金属反应的条件 题目:常温下,浓硫酸能否与金属铁发生反应? 错误答...
鲍林在研究含氧酸时,将其化学式一般写作 HRO,其中 R 代表中心原子,羟基(–OH)与...
...
一、银47Ag 银亲硫,极化能力强。在自然界中常以自然银、硫化物等形式存在,因其离子...
一、镓Ga 从铝土矿Al 2 O 3 或闪锌矿Zns的冶炼过程中提取,最后经电解制得纯净镓。 门...