
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
给学生带来体验和经历,是化学中物质的性质教学中非常重要的一种教学思想。记忆得到的性质感受是缺少生机的,体验得到的性质感受是活灵活现的。
1、要学会研究一种物质的几个步骤
(1)研究结构,预测化学性质(或物理性质)
(2)观察物理性质。
(3)研究化学性质。
(4)思考用途。
2、要学会如何研究物质的化学性质
让这种物质与不同类别的化学物质去反应。同类别的物质具有相似的性质,可以进行知识的扩展。
化学物质的类别包括金属、非金属、氧化物、酸、碱、盐反应。
3、钠
(1)钠的结构:
单质钠由钠原子组成的。Na的原子结构中最外层有1个电子,很容易失去。
推理出:钠的化学性质很活泼,在反应中表现出很强的还原性和金属性。
(2)钠的物理性质:
【实验】观察钠的切割,钠的外观。注意钠的存放环境。
现象:得到钠的颜色为银白色,有金属光泽。钠的状态为固体。钠的硬度低。
通过钠的加热实验得到钠的熔点低。
通过钠与水的反应实验得到钠的密度比水小。
(3)钠的化学性质:
①与非金属单质O2的反应:
【实验】观察钠切割后的变化。
现象:得到钠与空气中氧气很快反应,生成Na2O:4Na+O2=2Na2O。
很多金属与氧气不能快速反应,说明钠的还原性很强。
【实验】观察钠在空气中的加热。
注意实验仪器:三脚架、泥三角、坩埚。
现象:先熔化,后剧烈燃烧,有黄色火焰,生成淡黄色固体。指出此固体为Na2O2:2Na+O2 Na2O2。
Na2O2。
继续思考和推理:其它金属没听说过生成过氧化物,可能与钠的活泼性强有关。K和Ca点燃也可能生成过氧化物(让学生自己解决)。
指出Na与Cl2、S、Br2、I2等都反应,生成正常价态的化合物。
②与氧化物H2O的反应:
【探究实验】观察钠与水反应,注意仔细观察现象,要细致,要全面。
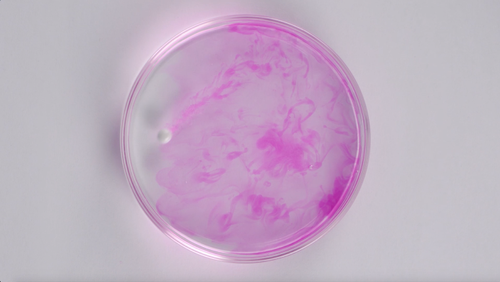
现象:熔化,浮在水里,到处游动,有声音,酚酞溶液变红。
对每一个现象做出解释:反应放热,钠的密度比水小,有气体生成,反应剧烈,有碱生成。
推理方程式:根据氧化还原反应的道理,推理出气体为H2:
2Na+2H2O=2NaOH+H2↑
继续思考和推理:钠与水能反应是因为钠活泼,比钠更活泼的K和Ca应该也能与水反应,方程式应该也与钠的类似。
继续思考:钠为什么保存在煤油或石蜡油中?因为钠与空气中氧气快速反应,钠与水也能剧烈反应。
钠失火应该怎么灭火?不能用水,用干燥沙土。
钠与水能剧烈反应,而很多金属与水不能反应,说明钠还原性很强。
③与酸溶液的反应
思考得:先和酸反应,如果钠有剩余,还和水反应。
钠与盐酸反应:2Na+2HCl =2NaCl +H2↑。
如果剩余Na:2Na+2H2O=2NaOH+H2↑。
注意钠与酸反应的宏观的先与后,微观的先与后的区别。
宏观的先与后,是先和酸反应,再和水反应。
微观的先与后,应该是先主要和水反应生成NaOH(可能会有少量的H+同时与钠反应),生成的NaOH立刻被酸中和,消耗完酸后,剩余的Na继续与水反应。
④与盐溶液的反应
思考得:先和水反应,生成的NaOH,NaOH再和某些盐反应。
这与一般的活泼金属和不活泼金属盐溶液的置换反应不同。
【实验】钠与CuSO4溶液反应:
现象:有蓝色沉淀立刻生成,无红色物质出现。蓝色沉淀在反应过程中或放置一段时间后局部有黑色出现。
2Na+2H2O =2NaOH+H2↑
2NaOH +CuSO4=Cu(OH)2↓+Na2SO4
合起来得到:2Na+2H2O +CuSO4= Cu(OH)2+Na2SO4+H2↑
黑色物质是因为Cu(OH)2很不稳定,在水溶液中受热或见光就会分解:Cu(OH)2 CuO+H2O。
CuO+H2O。
练习:钠与FeCl3溶液的反应
(4)钠的用途:教材中没有涉及。
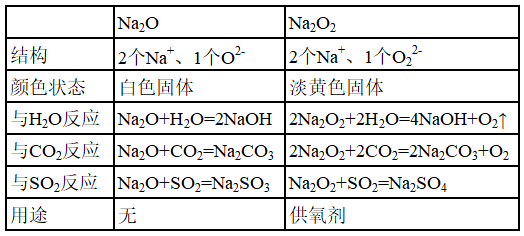
4、Na2O与Na2O2
Na2O代表的是活泼金属的碱性氧化物的性质。Na2O2代表的是过氧化物的性质。
可以采用表格法,产生对比,有利于快速学会。
(1)Na2O
①Na2O的结构:2个阳离子Na+和1个阴离子O2-构成。
②Na2O的物理性质:白色固体。
③Na2O的化学性质:活泼金属的碱性氧化物,与水、酸性氧化物、酸等能反应。
Na2O+H2O =2NaOH
Na2O+CO2=Na2CO3
Na2O+H2SO4=Na2SO4+H2O
④Na2O的用途:教材无表述。
(2)Na2O2
①Na2O2的结构:2个阳离子Na+和1个阴离子O22-构成。O的价态为-1,属于不常见价态。它是过氧化物,不是碱性氧化物。
②Na2O2的物理性质:淡黄色固体。
③Na2O2的化学性质:O的价态为-1,不常见价态,有强氧化性或强还原性。
A、与SO2的反应:
推理:SO2是强还原剂,Na2O2体现强氧化性,Na2O2+SO2=Na2SO4。在此反应中Na2O2得到2e-。
B、与水的反应【实验】
现象:有大量气泡产生,带火星的木条靠近气体后复燃。
2Na2O2+2H2O=4NaOH+O2↑
思考和分析:H-2O中元素的价态常见,没有强氧化性或强还原性。Na2O2既不能氧化水,也不能还原水。Na2O2中2个O(-1)相互氧化还原,1个变为O(-2),1个变为O(0),变为Na2O和1/2 O2。生成的Na2O和H2O反应生成NaOH。1个Na2O2转移1个e-。
【实验】Na2O2与CO2的反应(棉花团)
现象:棉花团燃烧。(反应放热,产生氧气)
2Na2O2+2CO2=2Na2CO3+O2
思考和分析:CO2中元素的价态常见,没有强氧化性或强还原性。Na2O2既不能氧化CO2,也不能还原CO2。Na2O2中2个O(-1)相互氧化还原,变为NA2O和1/2 O2。生成的Na2O和CO2反应生成Na2CO3。
④Na2O2的用途:在呼吸面具或潜水艇中作为氧气的来源。
对比表格如下
Na2O2溶于酚酞溶液时,不仅使溶液变红,还能使溶液褪色,Na2O2因为强氧化性有漂白作用。
5、焰色试验
(1)什么是焰色试验?用化学物质改变火焰颜色的试验。如节日烟花中各种颜色的呈现。
利用一些特殊的金属元素,就可以改变颜色。
这是一种物理性质。单质和化合物都可以呈现。
不是所有金属都使火焰改变颜色,像Pt、Fe等就不能。
(2)一些金属的焰色:

(3)如何进行焰色试验
【实验】钠、钾的焰色试验:
①将铂丝(或铁丝)在酒精灯外焰上烧至与原来火焰的颜色相同。
②用铂丝蘸取碳酸钠溶液,在外焰上灼烧,观察火焰颜色。
③用盐酸洗净铂丝。
④在酒精灯外焰上烧至与原来火焰的颜色相同。
⑤用铂丝蘸取碳酸钾溶液做同样的实验,此时要透过蓝色钴玻璃观察。
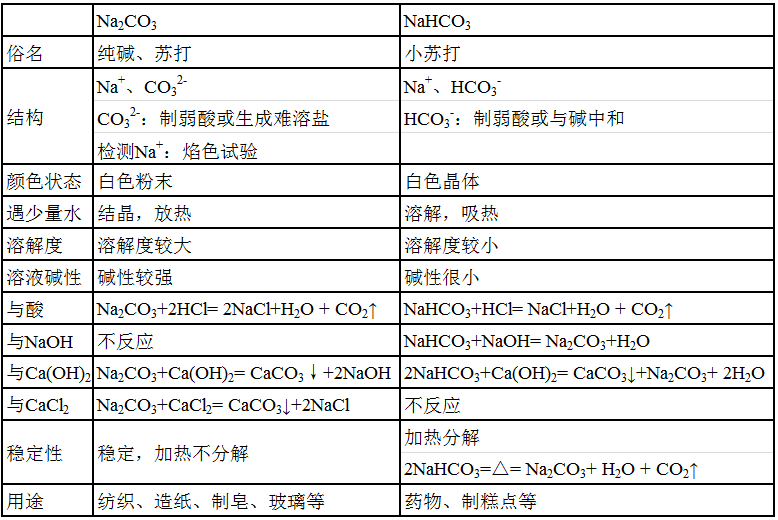
6、Na2CO3与NaHCO3
Na2CO3代表的是(可溶性)碳酸盐的性质。NaHCO3代表的是碳酸氢盐的性质。
采用表格法,产生对比。
【实验】先看视频实验《Na2CO3与NaHCO3的性质》,包括两种物质的状态观察,遇少量水的现象,加一定水的溶解情况,溶液中加酚酞的现象,热分解实验对比,与盐酸反应的快慢对比。再填写表格。
7、Na2CO3向NaHCO3的转化
(1)初中老师讲过澄清的石灰水中通入过量的CO2,浑浊又会变澄清。反应原理如下:
CaCO3+H2O + CO2=Ca(HCO3)2
(2)Na2CO3溶液中通入CO2也会发生类似反应。
Na2CO3+H2O + CO2=2NaHCO3
(3)饱和Na2CO3溶液中通入CO2会产生晶体。
Na2CO3(饱和)+ H2O + CO2=2NaHCO3↓
8、侯氏制碱法
(1)介绍侯氏制碱,主要是介绍侯德榜的伟大。
①1921年获得美国博士,然后像钱学森一样毅然回来报效祖国。
②他发明了新的联合制碱法,比索尔维制碱法更好。
③索尔维:因为制碱而成为富豪,他重视知识和人才交流,组织了多届著名的世界级物理化学会议——索尔维会议。
④侯德榜将自己的研究成果公布于全世界,他的世界观很伟大。
⑤报效祖国的价值观和人生观是人的一生爱学习、有成就有意义的一种强大的内在驱动力量。
(2)侯氏制碱法(联合制碱法)的第一个关键反应是:NaCl+H2O+CO2+NH3=NH4Cl+NaHCO3↓
2NaHCO3 Na2CO3+H2O+ CO2↑
Na2CO3+H2O+ CO2↑
第一个反应的设计非常有智慧。NaCl、H2O、CO2原料常见且便宜。NH3虽然不便宜,但它可以用来制氮肥,而此反应正好将NH3转化为肥效相当、方便运输的固态氮肥。
第二个反应中生成的CO2可以循环利用。联合制碱的原料利用率非常高。
9、简单的过量问题(滴加问题)
(1)Na2CO3溶液中滴入盐酸,反应的现象是开始不产生气泡,一段时间后开始产生气泡。
盐酸中滴入Na2CO3溶液,反应的现象是立刻产生气泡。
分析一下原因:CO32-与H+反应生成H2CO3(H2O +CO2)时,如果H+较少,会生成HCO3-。如果H+较多,会生成H2CO3(H2O +CO2)。
①Na2CO3溶液中刚开始滴入盐酸时,H+较少,发生反应Na2CO3+HCl=NaHCO3+NaCl。
当Na2CO3全部转化为NaHCO3时,再发生反应NaHCO3+HCl=H2O +CO2↑+NaCl。
②盐酸中刚开始滴入Na2CO3溶液时,H+较多,发生反应Na2CO3+2HCl= H2O +CO2↑+2NaCl。
所以,Na2CO3与盐酸的反应有两种情况:
Na2CO3+2HCl(过量)= H2O +CO2↑+2NaCl
Na2CO3+HCl(少量)= NaHCO3+NaCl
(2)NaOH溶液与CO2反应的过量问题
CO2+H2O相当于H2CO3,H2CO3是二元酸,有2个显酸性的H。当碱少时,会生成NaHCO3。当碱多时,会生成Na2CO3。
在NaOH溶液中通入CO2时,开始的反应为CO2+2NaOH(过量)= Na2CO3+H2O。
在盛满CO2的容器中滴入NaOH溶液时,开始的反应为CO2+NaOH(少量)= NaHCO3。
10、关于计算
化学中很多计算都不只是计算数据的问题,更重要的是理解明白化学过程的问题。
(1)关于NaHCO3受热分解的差量计算
不要急于介绍“差量法”。
要思考质量出现变化的原因。或者从2NaHCO3变成Na2CO3质量在减小的角度,或者从生成水蒸气和CO2而挥发掉的角度。
(2)关于NaHCO3、Na2CO3及混合物与盐酸反应生成CO2的图像分析问题
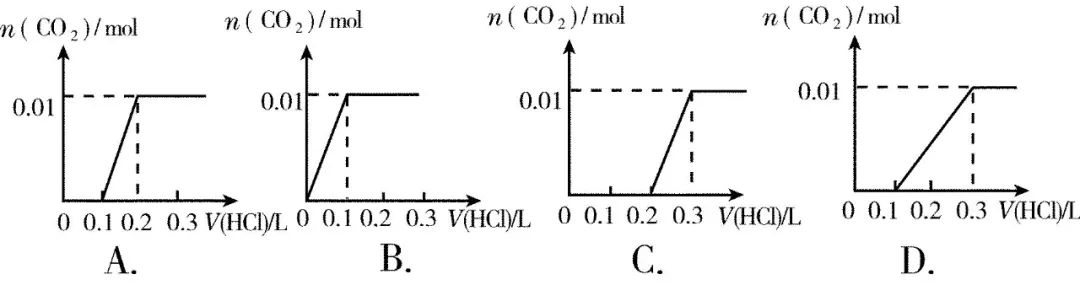
此问题很难,需要知道Na2CO3与盐酸反应的过量问题、NaHCO3和Na2CO3的混合溶液谁先反应的问题、NaOH和Na2CO3的混合溶液谁先反应的问题、反应中数量及叠加的问题。
11、关于实验
(1)关于钠与水反应实验,最好做演示实验。
如果要做学生实验,一定要到实验台上,穿实验服,戴护目镜,开通风等。曾经出现有学生将溶液撒到书本上,有学生将较大块的钠放入水中,有学生将钠放在带水的锥形瓶中,有学生在地面上洒落碎片钠,有学生将碎末状的钠扔到垃圾筒中,有学生被特殊气味熏得迷糊,有学生的衣服被腐蚀损坏等问题。
(2)教材中的各种实验,如果时间允许,不危险的实验,尽量做学生实验,有危险的实验,可以做演示实验。学生更愿意参与的是真实实验,而不是看视频实验。
(3)如果条件不允许,那也要看视频实验。实验是学生对化学的强大兴趣所在。兴趣才是最好的老师。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
绪言 1 、 17 世纪中叶,化学开始走上以 科学实验 为基础的发展...
一、配合物 1 、 CuSO 4 固体是白色的, CuCl 2 固体是棕黄色的,...
一、金属晶体与金属键 1 、固态的金属都是晶体,称为金属晶体...
一、共价键 (弄懂共价键的成键过程,对理解大 л 键和杂化轨...
一、能层与能级 1 、核外电子的分层 核外电子在能量不同的区域...
离子、原子、分子之间通过什么作用力形成宏观物质呢? 有些靠...