
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
就高考备考中,尤其关于铜的知识给同学们列出以下复习提纲:
1、概括为三大部分:
(1)铜的游离态——即铁单质
(2)铜的化合态——即铜的化合物(包括含铜元素的盐、碱、氧化物)
(3)铜的冶炼(火法、湿法炼铜、电解精炼)
2、铜单质的五个方面:
(1)铜原子结构、基态铜原子、Cu2+价电子排布、晶体铜结构
(2)铜在周期表中的位置
(3)金属铜物理性质(色、态、密度、熔沸点、硬度、导热、导电)
(4)金属铜化学性质(金属性很强、失电子能力很强、还原性很强)
(5)金属铜的制备与用途
3、含铜元素的氧化物——氧化亚铜、氧化铜
4、含铜元素的碱——氢氧化铜
5、含铜元素的盐——铜盐(Cu2+)
6、自学延伸:含铜元素的配合物
铜,是一种古老的金属,较之现今最常用的铁器,还要再早2000年。铜是人类知道最早的金属之一,也是人类广泛使用的第一种金属。人类使用铜的历史悠久,把锡掺入铜中制成铜锡合金——青铜,引领人类进入了青铜器时代(公元前3000年~公元前1000年左右),结束了人类历史上的石器时代。
公元前660年,位于小亚细亚中西部濒临爱琴海的吕底亚(Lydia,现土耳其的西北部),盛产一种银和金混合的矿物,他们用这种“白色的金子”铸造了钱币。到了最后一代国王克鲁修斯时代,又出现了纯金币和纯银币。历史学家认为吕底亚可能是世界上最早使用金属硬币的国家。由于金银币的材料成本太高了,世界各国陆续开始使用色泽接近的廉价金属替代金银币作为目前常见的流通硬币。其中,铜合金是最主要的替代材料,在近代造币发展历程中发挥了极其重要作用。铜合金是以纯铜为基体,加入一种或几种其他廉价金属元素所构成的合金,通常分为金黄色的黄铜和青铜、银白色的白铜三大类。其中,黄铜以锌作为主要添加元素,青铜以锡作为主要添加元素,白铜以镍为主要添加元素。由于铜合金在色泽和性能上,非常符合造币的需求,因此在硬币生产中得到了广泛的应用。
偷偷告诉你,中国民间有利用老版5角硬币熔炼做成“金”戒指的情况,这是因为老版5角硬币采用金黄色的铜合金制造,而新版5角硬币为电镀材料无法进行变造。最后提醒大家注意:熔炼硬币加工首饰是属于违法行为!爱护人民币,人人有责!
在自然状态下,铜是比较稳定的一种金属,即使氧化都是比较缓慢的过程,并且需要一定条件如加热、光照等,而且氧化后氧化层还能起一定的保护作用。
在农业生产方面,铜制剂农药可以杀灭真菌和细菌,因其杀菌范围广、药剂持效期长、不易产生抗药性等优点在农业发展上广泛应用。使用最早的铜制剂是波尔多液,它是由硫酸铜和石灰调配而成的。在实际应用中,根据作物对石灰的敏感度,分为半量式、等量式和倍量式三种方式进行调配。另外蓝色粉末氢氧化铜也是一种常用的铜制剂,因其具有弱两性,故不可与强酸、强碱性农药及肥料混用。
铜在生命系统中起着重要作用,人体有30种含有铜的蛋白质和酶。血浆铜几乎全部结合在铜蓝蛋白(存在于血清)中,铜蓝蛋白具有亚铁氧化酶的功能,在铁的代谢中起着重要的作用。
从我国考古发掘来看,夏代已经能熔铸青铜。古代炼铜方法主要有火法和湿法两种。第一种为“火法炼铜”,例如以孔雀石为原料炼铜。殷墟考古发现,3000多年前我国古代劳动人民已运用了此方法。孔雀石与点燃的木炭接触而被分解为氧化铜,继而被还原为金属铜;第二种为“湿法炼铜”,中国人最早利用天然铜的化合物进行湿法炼铜,西汉时即利用硫酸与氧化铜反应,将铜矿中的铜元素转变成可溶性的硫酸铜,再将铁放入硫酸铜溶液中把铜置换出来,这种方法叫湿法炼铜。
今天我们就来好好认识一下铜及其化合物。
第一部分:金属铜
一、铜原子结构、基态铜原子价电子排布、晶体铜结构
1、基态铜原子核外电子排布
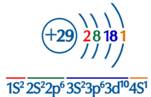
2、基态铜原子价电子排布
基态Cu:1s22s22p63s23p63d104s1,简写为[Ar]3d104s1
价电子排布为3d104s1。
铜具有0、+1、+2、+3等氧化态。
价电子轨道表达式如图
![]()
3、金属铜晶体结构:面心立方堆积

二、铜在周期表中的位置、同位素、存在与焰色
1、铜在周期表中的位置
位于第四周期ⅠB族,属ds区元素,该族称为铜族元素,包括铜、银、金。
2、铜族元素的价电子
它们的价电子层结构为(n-1)d10ns1。从最外电子层来看,它们和碱金属一样,都只有一个s电子。但是次外层的电子数不相同,铜族元素次外层为18个电子,碱金属次外层为8个电子(锂只有2个电子)。由于18电子层结构对核的屏蔽效应比8电子结构小得多,即铜族元素的原子的有效核电荷较多,所以本族金属原子最外层的一个s电子受核电荷的吸引比碱金属要强得多,因而相应的电离势高得多,原子半径小得多,密度大得多。
由于18电子层结构的离子,具有很强的极化力和明显的变形性,所以本族元素一方面容易形成共价化合物;另一方面本族元素离子的d、s、p轨道能量相差不大,能级较低的空轨道较多,所以形成配合物的倾向也很显著。
2、同位素
铜有29种同位素。其中63Cu和65Cu很稳定,63Cu在自然存在的铜中约占69%。其他同位素都有放射性,其中最稳定的是67Cu,半衰期61.83小时。62Cu和64Cu有重要应用。62Cu在62Cu-PTSM中用作正电子发射断层扫描的放射性示踪剂。
3、存在
在自然界中,游离态的铜很少见,铜的化合态主要以硫化物、氧化物和碳酸盐等含铜矿存在。例如:黄铜矿CuFeS2、辉铜矿Cu2S、赤铜矿Cu2O、孔雀石Cu2(OH)2CO3等。
三、金属铜物理性质(色、态、密度、熔沸点、硬度、导热、导电)
纯铜为紫红色具有金属光泽,论贵重程度,铜是一种仅次于金和银的贵金属,硬度却比金和银要大。熔、沸点高,密度8.9g/cm3,有良好的导热、导电(仅次于银)和延展性。
四、金属铜化学性质
1、与非金属单质(如O2、Cl2、S)的反应
(1)与O2加热:2Cu+O2![]() 2CuO
2CuO
(2)与O2高温:4Cu+O2![]() 2Cu2O
2Cu2O
(3)铜在干燥空气中比较稳定,在水中几乎看不出反应,与含有二氧化碳的潮湿空气接触,在铜的表面会慢慢生成一层铜绿
2Cu+O2+H2O+CO2===Cu(OH)2·CuCO3
(4)与Cl2点燃时:Cu+Cl2![]() CuCl2剧烈燃烧,生成大量棕黄色的烟
CuCl2剧烈燃烧,生成大量棕黄色的烟
(5)与S点燃时:Cu+S(g)![]() Cu2S(黑色)
Cu2S(黑色)
2、与酸反应
(1)与稀盐酸或稀硫酸等非氧化性的酸不反应,不产生氢气
(2)与氧化性酸(硝酸或热的浓硫酸):
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
2Cu+8HNO3(稀)=== 3Cu(NO3)2+2NO↑+4H2O
Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(3)在O2和H+共存环境中逐渐溶解
2Cu+O2+2H2SO4===2CuSO4+2H2O。
3、与某些盐反应
与FeCl3溶液反应:Cu+2Fe3+=== 2Fe2++Cu2+
与AgNO3溶液的反应:Cu+2Ag+===2Ag+Cu2+
4、用作乙醇催化氧化的催化剂
2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
五、工业炼铜
世界上由铜精矿生产电解铜的冶炼方法分为两大类:火法冶炼和湿法冶炼。目前精炼铜产量的80%以上是用火法冶炼生产的,湿法冶炼生产的精炼铜占20%左右。两种方法相比各有优缺点,在成本上湿法冶炼比火法冶炼要低,但冶炼纯度较低。现在冶炼铜用的主要矿石是斑铜矿(Cu5FeS4)。我国开采的主要是黄铜矿(铜与硫、铁的化合物),其次是辉铜矿和斑铜矿。
1、火法炼铜
火法炼铜是当今生产铜的主要方法,占铜产量的80%~90%,主要是处理硫化矿。火法炼铜的优点是原料适应性强,能耗低,效率高,金属回收率高。
火法工艺过程主要包括四个主要步骤:造硫熔炼、冰铜吹炼、粗铜火法精炼和阳极铜电解精炼。
下面我简单说说火法工艺中的主要变化:
造硫熔炼斑铜矿肯定是在高温下,这样就得到了冰铜(含铜50%左右,其他大部分是硫),冰铜吹炼吹的就是氧气,用氧气将冰铜中的硫和铁氧化除去。粗铜火法精炼分氧化过程和还原过程,在氧化过程中,空气鼓进铜熔体,跟铜反应生成Cu2O,已完成Cu的富集。还原过程就是用还原剂还原铜。此时的粗铜含铜96%以上。最后一个阶段是阳极铜电解精炼。用直流电溶解阳极铜,杂质进入阳极泥和电解液。阳极泥中富含金、银,通过回收阳极泥冶炼企业也能大赚一笔。有的时候加工费价格可以低于加工成本,就是因为阳极泥中的金银可以抵消一部分成本。
相关化学方程式如下:
2CuFeS2===Cu2S+2FeS+S
Cu2O+FeS===Cu2S+FeO
2FeS+3O2+SiO2===2FeO·SiO2+2SO2
2FeO+SiO2===2FeO·SiO2
2CuFeS2+O2===Cu2S+2FeS+SO2
2Cu2S+3O2===2Cu2O+2SO2
2Cu2O+Cu2S===6Cu+SO2↑
电解精炼铜的主要反应式
阳极:Cu-2e-=Cu2+
阴极:Cu2++2e-=Cu
上述的几个化学方程式在以铜矿冶炼铜的工艺中,经常作为考查点,同学们可以自行书写上述反应,并运用氧化还原反应原理加以分析,尤其是电子转移数目……
2、湿法冶炼
湿法炼铜技术开始于秦汉之际,当时的炼丹术士在从事炼丹中发现铁能够从硫酸铜溶液中置换出铜。
西汉《淮南万毕术》中记载,“白青得铁则化为铜”。
《梦溪笔谈》也说:“信州铅山县有苦泉,流以为涧,挹其水熬之,则成胆矾,烹胆矾则成铜,熬胆矾铁釜,久之亦化为铜。”
这些记载表明当时人们已有意识地利用化学的置换反应来获得铜。
这里结合高考,给大家划一划下面几个名词。
(1)“胆水冶铜法”是现代湿法冶金的先声。所谓“胆水”是指天然的含硫酸铜(也称石胆、胆矾)的泉水。
(2)东晋炼丹家葛洪在其《抱朴子·内篇》中说到,“以曾青涂铁,铁赤色如铜,……而皆外变而内不化也。”。其中“曾青”是碳酸铜类的矿物。
湿法冶炼占铜生产量的10%~20%,是用溶剂浸出铜矿石或铜精矿使铜进入溶液,然后从经过净化处理后的含铜溶液中回收铜的方法。湿法炼铜设备更简单,在矿山附近就近生产,生产成本低,不生产硫酸,无SO2污染。但杂质含量较高,且炼铜周期长、效率低、产能规模小。
湿法冶炼工艺过程主要包括四个步骤:浸出、萃取、反萃取、金属制备(电积或置换)。
下面我简单说说首发湿法工艺中的主要变化:
首先焙烧铜矿,然后用溶剂浸出。一般使用硫酸或氨溶液(不腐蚀设备且与有色金属络合),在最后一步电积就是大家再熟悉不过的初中从硫酸铜溶液中制取铜的氧化还原方程式了。
六、金属铜的用途
1、电气工业;
2、冶金工业。
3、航天工业。
第二部分:铜的化合物
一、铜的氧化物
化学式 | Cu2O | CuO |
名称 | 氧化亚铜 | 氧化铜 |
颜色状态 | 红色粉末 | 黑色粉末 |
溶解性 | 难溶于水 | 难溶于水 |
铜的氧化态 | +1 | +2 |
1、氧化亚铜的化学性质
(1)具有弱碱性,与H+发生歧化反应:Cu2O+2H+=Cu+CuO+H2O
(2)稳定性:对热十分稳定,在1235℃熔化但不分解。
2、氧化铜的化学性质
(1)为碱性氧化物,与H+反应:CuO+2H+=Cu2++H2O
(2)氧化性:
在高温下,可被一些还原剂还原。
(3)稳定性:对热较稳定,加热到1000℃分解
4CuO![]() 2Cu2O+O2↑
2Cu2O+O2↑
二、铜的氢氧化物——氢氧化铜
氢氧化铜,分子式Cu(OH)2,干粉末呈现蓝色或晶体,常表现为蓝色絮状沉淀,难溶于水,受热分解,微显两性,溶于酸、氨水和氰化钠,易溶于碱性甘油溶液中,温度分解为黑色氧化铜和水。
说明:苏教版《实验化学》第32页“课题1牙膏和火柴头中某些成分的检验”中“知识预备”里提到关于“甘油的检验方法”提到了新制Cu(OH)2。该实验利用甘油与新制Cu(OH)2悬浊液(也可以是干态粉末)在强碱性条件下反应得到绛蓝色溶液。从而对“牙膏中的甘油”进行相关实验检验。
三、含铜元素的盐
1、硫酸铜
硫酸铜常用作分析试剂,例如可用于生物学中配置鉴定还原糖的斐林试剂和鉴定蛋白质的双缩脲试剂的b液,不仅如此,硫酸铜还被应用于农业领域,他能与石灰水混合后生成波尔多液,作为杀菌剂,用于控制作物上的真菌,防止果实腐烂。
(1)无水CuSO4为白色粉末,易溶于水,不溶于乙醇和乙醚,吸水性很强,吸水后显出水合铜离子的特征蓝色。常用这一性质来检验一些有机物如乙醇、乙醚等中的微量水分。
CuSO4+5H2O=CuSO4·5H2O(五水硫酸铜,俗称胆矾、蓝矾)
(2)CuSO4在电解、电镀中常用来做电解液或电镀液。如用惰性电极电解CuSO4溶液:
2Cu2++2H2O 2Cu+4H++O2↑
2Cu+4H++O2↑
(3)铜盐属于重金属盐,可使蛋白质变性,故铜盐有毒。CuSO4被用在蓄水池、游泳池中可防止藻类生长,与石灰乳混合配制的“波尔多液”在农业上用来消灭植物病虫害。
CuSO4+Ca(OH)2=CaSO4+Cu(OH)2
(4)在硫酸铜溶液中逐滴加入过量氨水,先生成蓝色沉淀,沉淀溶解,得到深蓝色溶液;加入无水乙醇,又得到深蓝色晶体[Cu(NH3)4]SO4·H2O:
Cu2++2NH3·H2O=Cu(OH)2+2NH4+
Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
(5)向CuSO4溶液中通入H2S气体,现象有黑色沉淀生成。
Cu2++H2S=CuS↓+2H+
该反应能发生是因为生成难溶物,而不是弱酸可以制备强酸的佐证。
2、碱式碳酸铜
Cu2(OH)2CO3的名称为碱式碳酸铜,呈绿色、暗绿色或淡蓝绿色,是铜锈的主要成分,不溶于水,新制品在沸水中分解,溶于稀酸和氨水。通常用CuSO4·5H2O和Na2CO3为反应原料制得。加热至220℃以上分解,其方程式为Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑。
2CuO+H2O+CO2↑。
四、铜(Ⅰ)的性质及验证
(1)+1价的铜有较强的还原性,易被氧化剂氧化为+2价。
(2)+1价铜在酸性条件下能发生歧化反应生成Cu和Cu2+,利用这一原理可区别Cu和Cu2O。向红色物质中加入稀硫酸,若溶液由无色变成蓝色,则该红色物质为Cu2O,否则为Cu。反应的化学方程式为Cu2O+H2SO4===CuSO4+Cu+H2O。
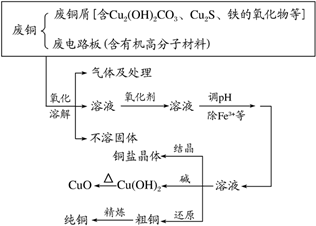
五、废铜综合利用的常见流程
第三部分:重要的化合物
一、氧化铜
氧化铜(CuO)是一种铜的黑色氧化物,稍有吸湿性。相对分子质量为79.545,密度为6.3~6.9 g/cm3,熔点1326℃。不溶于水和乙醇,溶于酸、氯化铵及氰化钾溶液,氨溶液中缓慢溶解。灼热的CuO可被氢气、碳或一氧化碳还原为铜。
二、胆矾与“胆铜术”
胆矾,古称“石胆”,英文名称为“Chalcanthite”,源于希腊语的两个单词“铜”和“花”,这意味着它含有铜,并像花朵一样美丽。事实上正是如此,胆矾是一种硫酸铜水合物,化学式为CuSO4·5H2O,有时候会含有少量镁和锌。在汉语中,“矾”是指某些金属硫酸盐的含水结晶,是一些易溶于水的矿物,如明矾(十二水硫酸铝钾)、绿矾(七水硫酸亚铁)、皓矾(七水硫酸锌)等都属于此类。
《三国演义》中“诸葛亮七擒孟获”提到蜀军的先锋王平将军带领数百军士探路中因引用“哑泉”之水而中毒,后遇山中高人指点,获取解药。研究发现,“哑泉”确实存在,位于云南省保山市境内,明清时期人们在泉边立下石碑,提示过往行人勿饮此水。所谓的“哑泉”应该是一种含硫酸铜较高的泉水,因为云南铜矿资源丰富,自古就已开采,硫酸铜的毒性很大,安全服用胆矾的量为每次0.5~1g,超过10克即可致人死亡。
用胆矾炼铜的方法自古有之,是世界上最早的湿法冶金技术,我们称这种方法炼出的铜为“胆铜”。南宋学者李心传在《建炎以来朝野杂记》一书中记载:“坑皆有胆铜者,盖以铁为片,浸之胆水中,后数十日即成铜。”
北宋科学家沈括在《梦溪笔谈》中提到:“信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾,烹胆矾则成铜,熬胆矾铁釜久之亦化为铜。水能为铜,物之变化,固不可测。按《黄帝素问》有‘天五行,地五行。土之气在天为湿,土能生金石,湿亦能生金石’,此其验也。”
但是,沈括用阴阳五行学说来解释这种现象,有失科学道理,但这也是受到当时生产力发展和科学水平的限制所造成的认识误差。
用胆矾炼铜的方法很简单,就是将铁置于含有胆矾的溶液中,铜离子会被置换出来,沉淀下来的铜就是胆铜。古人利用这种方法制造出了大量的铜制品,特别是在宋代,由于铸币的需要,胆铜术极为兴盛。有数据显示,在北宋末年,胆铜的产量已经达到了100万吨。
胆铜术实际上是一种中学化学中的置换反应,即硫酸铜溶液与铁作用,生成硫酸亚铁和金属铜。
三、血蓝蛋白
在上期中,告诉了大家为什么我们的血液是红色的。
你知道章鱼、虾等某些动物的血液是蓝色的吗,这就奇怪了,像动物里的其他鱼,鸡等都是红色的血,那为什么章鱼的血是蓝色的呢?
这是因为章鱼体内有一种血蓝蛋白,又叫血青素,我们的人类的是血红蛋白,而血蓝蛋白也是章鱼能够在极端温度下存活的原因。
血蓝蛋白是一种含有与等量氧原子结合的铜原子的血源性蛋白,游离于无脊椎动物的血浆中。血蓝蛋白与血液中的氧气结合,并被输送到章鱼的整个身体,为其身体组织供氧,这是章鱼在恶劣环境下生存的关键。章鱼是有三颗心脏的,所以与其它大多数无脊椎动物相比,章鱼需要更多氧气。即便它们所处的环境难以获取氧气,血蓝蛋白也能使章鱼获得稳定的氧气供应。同时,该物质还确保了章鱼能够在恶劣、致命的温度中存活下来,从28华氏度(-2℃)的低温到海底热泉附近的高温(60~464℃不等)。
铜作为血蓝蛋白的成分,它在虾的血液和呼吸中起到重要作用,有助于形成黑色素,虾缺乏铜会变得生长缓慢,血液和肝胰脏中的铜含量减少,会使得虾容易感染疾病,死亡率提高。
四、自然铜
宋代寇宗爽在1116年在动物身上做了一些临床药理实验后在《本草衍义》中写道:“有人以自然铜饲折翅胡雁,后遂飞去。今人(以之治)打扑损。”胡雁的翅膀折断了,然后进行试验,这就是现代药理试验用的雏形。给折翅胡雁喂饲自然铜,雁骨伤愈后,就展翅高飞了。然后又把这成功的试验结果应用到临床,给骨折病人服用治疗。
下面的内容,当你看完以后,一定会让你重新认识世界……
自然铜是中药学中的一个名词,其原矿物是黄铁矿。是的,没有错,它是黄铁矿,又名愚人金,是硫化物矿物,化学式为FeS2。它的英文是“Pyrite”,来源于希腊文“PGR”,意思是火。黄铁矿具有金黄色的强金属光泽。黄铁矿在工业上是制造硫酸的原料。
啊?……自然铜中居然不含Cu元素!!!!!
不不不,在某些自然铜中还含铜、镍、砷、锑等杂质。
五、斐林试剂与双缩脲试剂
1849年,德国化学家斐林(Hermann Vonfehling,1812~1885年)发明了斐林试剂。它是由氢氧化钠的含量为0.1 g/mL的溶液和硫酸铜的含量为0.05 g/mL的溶液,还有含量为0.2g/mL酒石酸钾钠配制而成的,其本质是铜离子和酒石酸形成的配合物——酒石酸合铜(高中认为是新制的氢氧化铜)。
双缩脲试剂的成分是质量浓度为0.1 g/mL的NaOH溶液(双缩脲试剂A液)和质量浓度为0.01 g/mL的CuSO4溶液(双缩脲试剂B液)。在碱性溶液中,双缩脲(H2NOC-NH-CONH2)能与Cu2+作用,形成紫色或紫红色的络合物,这个反应叫做双缩脲反应。由于蛋白质分子中含有很多与双缩脲结构相似的肽键,因此,蛋白质可与双缩脲试剂发生特定的颜色反应。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。1.皓矾: ZnSO 4 ·7H 2 O 2.钡餐,重晶石: BaSO 4 3.绿矾,皂矾,青矾: FeSO 4 ·7...
少量、适量、足量和过量,这几个词是化学实验和计算中的核心定量描述,区别主要在于反...
一、基础概念:从 “温度强度” 看五者的核心差异 首先需明确:这五种操作本质都是 “...
【导读】“强酸制弱酸”是复分解反应的常见规律,其本质是强酸电离出的H更易与弱酸根...
在高中化学中,很多同学从初中就学习了复分解反应, 都知道复分解反应中“强酸制弱酸...
1.水银:汞Hg 2.过氧一硫酸:过氧硫酸过硫酸 H 2 SO 5 3.白金:主要成分铂 Pt 4.苯:C...