
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
01.铁在地壳中的含量居第四位,仅次于氧、硅和铝,铁可以单质形态存在,比如陨铁。
02.铁的原子结构示意图:
 ,
,
铁易失去2个电子,还可以失去次外层的1个电子。
03.铁与氧气反应,缓慢氧化生成Fe2O3,点燃生成Fe3O4方程式为3Fe + 2O2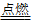 Fe3O4。
Fe3O4。
04.铁丝在氯气中燃烧时,生成棕黄色的烟,加水振荡后,溶液显黄色.2Fe + 3C12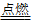 2FeCl3
2FeCl3
05.铁跟硫反应时,只能生成+2价铁,Fe + S FeS。
FeS。
06.铁跟氯气、硫反应时,分别生成+2价和+3价的铁,说明氧化性:氯气>硫.
07.在常温下,在水和空气中的O2、CO2等的共同作用下,Fe易被腐蚀(铁生锈)。
08.在高温下,铁能与水蒸气反应生成H2:3Fe + 4H2O(g) Fe3O4+4H2
Fe3O4+4H2
09.常温下,铁与水不起反应,但在水和空气里的O2等共同作用下,铁容易生锈。
10.铁与非氧化性酸(如稀盐酸、稀H2SO4等)的反应。例如:Fe + 2H+ = Fe2++ H2↑
11.铁遇到冷的浓H2SO4、浓HNO3时,会发生生钝化在金属表面形成致密的氧化膜,阻碍反应的进一步进行,故可以用铁制品或铝制品盛装冷的浓硫酸和浓硝酸。
12.铁与与稀HNO3反应,
铁少量Fe + 4H+ + NO3-= Fe3++ NO↑ + 2H2O,
铁过量3Fe + 8H+ + 2NO3- = 3Fe2++ 2NO↑ + 4H2O
13.铁与比铁的活动性弱的金属的盐溶液发生置换反应。例如:Fe + Cu2+= Fe2++ Cu。
14.FeO是黑色固体;Fe2O3是红棕色固体,俗称铁红;Fe3O4是黑色晶体,俗称磁性氧化铁。
15.FeO 中铁元素的化合价是+2价,Fe2O3中铁元素的化合价是+3价,Fe3O4中铁元素的化合价是既有+2价又有+3价,其平均化合价是+8/3价。
16.FeO在空气中加热时,被迅速氧化;
6FeO + O2 2Fe3O4。
2Fe3O4。
17.FeO与盐酸反应:
FeO+2HCl===FeCl2+H2O;4FeCl2+O2+4HCl===4FeCl3+2H2O
(总:4FeO+12HCl+O2===4FeCl3+6H2O)
18.FeO、Fe2O3是碱性氧化物,Fe3O4是复杂的氧化物。
19.Fe2O3与盐酸等反应:
Fe2O3+6HCl===2FeCl3+3H2O,
Fe2O3+6H+=2Fe3++ 3H2O
20.Fe2O3在高温时,被CO、C、Al等还原:
Fe2O3 + 3CO 2Fe + 3CO2
2Fe + 3CO2
21.Fe3O4兼有FeO和Fe2O3的性质,如Fe3O4 + 8H+=2Fe3++ Fe2++ 4H2O
22.Fe(OH)2在水中为白色絮状沉淀,Fe(OH)3在水中为红褐色絮状沉淀。
23.实验室制备Fe(OH)2可以利用可溶性亚铁盐与强碱溶液或氨水反应:
Fe2++ 2OH- = Fe(OH)2 或Fe2++ 2NH3·H2O= Fe(OH)2↓ + 2NH4+
24.制备Fe(OH)2时,为防止Fe(OH)2被氧化,应将装有NaOH溶液的滴管插入FeSO4溶液的液面下,以及在FeSO4溶液上方加入苯或汽油等溶剂、以及将NaOH溶液加热煮沸等。
25.Fe(OH)2极易被氧化,沉淀特征颜色变化:白色→灰绿色→红褐色,
方程式是4Fe(OH)2 + O2 + 2H2O = 4 Fe(OH)3
26.实验室制备Fe(OH)3可以利用可溶性铁盐与强碱溶液、氨水反应。
Fe3++ 3OH- = Fe(OH)3↓ 或Fe3++ 3NH3·H2O= Fe(OH)3↓ + 3NH4+
27.Fe(OH)2、Fe(OH)3都能与非氧化性酸如盐酸等中和。
28.Fe(OH)3受热分解2 Fe (OH)3 Fe2O3+3H2O,固体颜色变化:红褐色→红棕色。
Fe2O3+3H2O,固体颜色变化:红褐色→红棕色。
难溶于水的氢氧化物加入分解为对应的相同价态的氧化物和水。
29.亚铁盐很容易被空气中的O2氧化成铁盐,为防止氧化,可向亚铁盐溶液中加入一定量的铁屑.
30.可以利用2Fe3++ Fe===3Fe2+除去亚铁盐(含Fe2+)溶液中混有的Fe3+
31.氯化铁溶液中混有氯化亚铁时,可向溶液中通入足量氯气或滴加新制的氯水,除去Fe2+。
离子方程式是2Fe2++ Cl2=2Fe3++ 2Cl-。
32.Fe2+、Fe3+之间可以进行相互转化
Fe2+与氧化剂如Cl2、O2、H2、O2、HNO3等生成Fe3+
Fe3+与还原剂如Zn、Fe、Cu、H2S、HI等生成Fe2+
33.Fe2+的检验方法:
①向待检液中滴加NaOH溶液,若立即产生白色沉淀,迅速变为灰绿色,最终变为红褐色,则含有Fe2+;
②向待检液中先滴加KSCN溶液,若无明显变化,再滴加新制的氯水,溶液显红色,则含有Fe2+;
有关的离子方程式为:2Fe2++ Cl2===2Fe3++ 2Cl- Fe3++ 3SCN-===Fe(SCN)3
③取待检测溶液少许,往里滴加K3[Fe(CN)6],若出现蓝色沉淀,
34.Fe3+的检验方法:
①向待检液中滴加NaOH溶液,若产生红褐色沉淀,说明含Fe3+;
②向待检液中滴加KSCN溶液,溶液呈血红色,说明含Fe3+;
③取待检测溶液少许,往里滴加K4[Fe(CN)6],立即出现蓝色沉淀;

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、单质铁 1、铁元素的存在 (1)游离态: 存在于 陨铁 中 (2)化合态 2、铁的原子...
一、铝合金 1 、铝 ( 1 ) Al 的物理性质:银白色金属。导电能力好,是导电的主要材...
这节课结合复习氧化还原反应,体会物质的氧化性、还原性,特别是注意训练氧化还原反应...
...
...
...