
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、溶解性
SO2易溶于水(1:40体积比),由于这一点,实验室中常使用溶质的质量分数为70%左右的硫酸,也可用浓硫酸与Na2SO3固体反应制取SO2。但一定不能用很稀的硫酸,因为SO2在水中的溶解度较大,常温常压下1体积水能溶解40体积的SO2。
二、SO2的漂白性
二氧化硫能跟某些有色物质化合生成不稳定的无色物质,从而将某些有色物质漂白。如:SO2能使品红试液褪色,体现了SO2的漂白性。经二氧化硫漂白的无色物质长久放置或加热又会发生分解,物质又会恢复原色,所以二氧化硫的漂白过程是可逆的。也就是说二氧化硫的漂白是暂时性的,而次氯酸和过氯化钠的漂白是永久性的。工业上常用二氧化硫漂白某些有色物质。此外,二氧化硫还能够杀灭霉菌和细菌,可以用作食物和干果的防腐剂。
几种常见物质的漂白性比较
| 具有漂白性的物质 | ||
物质 | HClO、O3、H2O2、Na2O2 | SO2 | 木炭 |
原理 | 将有色物质氧化分解 | 与有色物质结合生成无色物质 | 将有色物质的分子吸附在其表面 |
实质 | 氧化还原反应 | 非氧化还原反应 | 物理吸附 |
效果 | 永久性 | 暂时性 | 暂时性 |
范围 | 可漂白大多数有色物质,能使紫色石蕊褪色 | 可漂白某些有色物质,不能使石蕊试液褪色 | 可吸附某些有色物质的分子 |
如把Cl2和SO2等物质的量混合用于漂白,能否增强漂白效果?为什么?
〖答案〗不能,两者会发生反应:SO2+Cl2+2H2O=== H2SO4+2HCl,从而完全失去漂白作用。
三、酸性
SO2具有氧化物的通性。表现在:
⑴与水反应:
生成的亚硫酸是一种不稳定的中强酸(易分解生成二氧化硫和水),有较强的还原性和较弱的氧化性。
⑵与碱反应:用量不同,可以生成两种盐
2NaOH十SO2(不足量)=Na2SO3十H2O NaOH十SO2(过量)=NaHSO3
说明:SO2气体类似于CO2气体,当向石灰水通入SO2气体时,能析出白色沉淀,当SO2过量时沉淀又溶解。
Ca(OH)2十SO2=CaSO3↓十H2O CaSO3+SO2+H2O=Ca(HSO3)2
但应特别注意的是:当SO2通入到与CaC12、BaC12溶液中,没有沉淀产生,也即不能与CaC12、BaC12反应。这一点同学们最容易出错。
[例1] 将SO2通到红色酚酞试液中,发现红色消失,主要是因为SO2 ( )
(A)有漂白性 (B)有还原性 (C)有氧化性 (D)溶于水后显酸性
[答案] (D)
[解析] 显红色的酚酞试液是因为酚酞遇碱呈红色的缘故,通入SO2实际上就是加入亚硫酸,亚硫酸中和碱并使溶液呈酸性,而酚酞在酸性条件下为无色,所以颜色消失,并不是漂白性造成的。
四、氧化性
+4价的硫有弱的氧化性,主要表现在与硫化氢的反应上SO2+2H2S=3S+2H2O(气体、溶液中均可反应)
[例2]下列反应中,SO2表现氧化性的是 ( )
A.2SO2+O2→2SO3 B.SO2+H2O===H2SO3 C.2H2S+SO2===3S↓+2H2O D.SO2+2H2O+Cl2===H2SO4+2HCl
[答案] (C)[解析] SO2在反应中表现氧化性,即要接受电子,化合价降低。
(A)项反应 硫的化合价升高,(B)项反应 硫的化合价未变,(C)项反应 硫的化合价降低,(D)项反应 硫的化合价升高,只有(C)项符合题目要求。
五、还原性
⑴与氧气的反应:
由于SO2中硫元素为+4价,属于中间价态,所以SO2既有氧化性又有还原性。与氧气在催化剂存在时反应,但在空气中是不易被氧气氧化的。
SO3在标准状况下是一种无色固体,熔沸点较低。SO3是H2SO4的酸酐。SO3十H2O=H2SO4此反应发生时放出大量的热。上述两个反应用于工业上制硫酸。
⑵被氯水氧化:
SO2+Cl2+H2O=H2SO4+2HCl,SO2也能被溴水,碘水氧化:SO2+2H2O+I2=H2SO4+2HI
⑶被其他氧化剂所氧化(如高锰酸钾、硝酸等),能使KMnO4(H+)溶液褪色。
5SO2+ 2KMnO4+ 2H2O == K2SO4+ 2MnSO4+ 2H2SO4
SO2+ 2HNO3== H2SO4+ 2NO2
[例3] C12和SO2都具有漂白作用,若将等物质的量的这两种气体混合后,通入品红和BaC12的混合溶液,能观察到的现象是( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
(A)①② (B)①③ (C)②③ (D)②④
[答案] (C)
[解析] 尽管潮湿的C12和SO2都具有漂白作用,但C12具有强氧化性,而SO2具有还原性,若同时使用,它们将会发生如下反应:C12+SO2+2H2O=H2SO4+2HCl,这样两者等物质的量混合,会完全丧失漂白作用,溶液不会褪色,而生成的H2SO4会和BaC12反应生成不溶于水和酸的白色沉淀BaSO4。
[例4] 我国农业因遭受酸雨而造成的损失每年高达15多亿元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
⑴正常雨水的pH约为5.6,这是因为溶解了二氧化硫的缘故。酸雨的pH<5.6。现取某地雨水样品一份,每隔一段时间测定一次该雨水样品的pH,所得数据如下:
测试时间/h | 0 | 1 | 2 | 3 | 4 |
雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
分析数据,回答下列问题:
①雨水样品的pH变化的原因是(用化学方程式表示) ;
②如果将刚取样的上述雨水与自来水相混合,pH将变 ,原因是(用化学方程式表示) 。
⑵你认为减少酸雨产生可采取的措施是 。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
⑶在英国进行的一项研究结果表明,高烟囱可以有效地降低地面SO2浓度。在20世纪的60年代~70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建筑高烟囱的结果,SO2地面浓度降低了30%之多。请从全球环境保护的角度,分析这种方法是否可取?简述其理由。
解析 分析图表可知,从开始到4小时之间,雨水样品的pH不断减小,说明酸性逐渐增强,从4小时以后,雨水样品的pH不再发生变化,说明酸性不变。H2SO3为中强酸,只发生部分电离,所以开始时pH较大;H2SO3具有还原性,易被空气中的O2氧化为强酸H2SO4,随着时间延续H2SO3逐渐变为H2SO4,pH不断减小;当H2SO3全部转化为H2SO4后,溶液的pH不再变化。自来水中有强氧化剂Cl2(或HClO)。减少硫的排放才能减少酸雨的产生。
雨水放置时pH逐渐变小,是因为雨水中H2SO3被空气中氧气逐步氧化成强酸H2SO4。雨水与自来水混合,H2SO3也被自来水中的Cl2(或HClO)氧化成强酸H2SO4,故pH也将变小。
答案 ⑴①2H2SO3+ O2== 2H2SO4 ②小; H2SO3+ Cl2+ H2O == H2SO4+ 2HCl (或H2SO3+ HClO == H2SO4+ HCl )
⑵ C ⑶不可取,加高烟囱并没有减少SO2的总产量,所以从全球总体看,高空的SO2仍然会形成酸雨。
[例5] 为防治酸雨。降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合使用,请写出燃烧时,有关“固硫”(不使含硫的化合物进入大气)反应的化学方程式为_____、______、______。
分析:
此题所涉及的内容和工业生产、日常生活密切相关,有些内容可能学生不知道。解答本类题目关键是对所给的信息进行充分的加工,利用所学的基础知识、基本原理、已有的经验解答题目。此题关键知道酸雨的形成是由于燃煤产生大量的SO2溶于水,即有反应S+O2=SO2。加入生石灰后必发生反应SO2+CaO=CaSO3,将SO2转化为CaSO3而不排放到大气中,同时知道CaSO3不稳定将和空气中的O2发生反应,即:2CaSO3+O2=2CaSO4。
[例6] 某学生课外活动小组利用右图所示装置分别做如下实验:
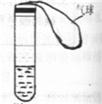
⑴在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢 复红色,则原溶液可能是 溶液;加热时溶液由红色逐渐变浅的原因是 。
⑵在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是 溶液;加热时溶液由无色变为红色的原因是 。
解析 根据图中装置分析:
⑴中红色溶液可以是试剂与指示剂作用变红色,加热后试剂挥发为气体,红色变浅,冷却后,气体又溶解在原溶液中又变红色。
⑵中一种气体溶解在原红色溶液中,并反应生成无色物质,加热后,又放出反应的气体,无色物质又变为有色物质,冷却后,气体又溶解在原溶液中,与有色物质反应生成无色物质。
答案:
⑴稀氨水和酚酞;稀氨水中NH3逸出,所以颜色变浅。
⑵溶有SO2的品红;SO2从溶液中逸出,品红溶液恢复原红色。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、拟卤素 1、涵义 某些原子团形成的分子,与卤素单质分子的性质相似,它们的阴离子...
一、 心概念与知识网络 “反应历程”或“反应机理”是近年来高考化学的热点。它不再是...
一、硫和金单质的反应 据我国古代第一部药物学专著《神农本草经》记载:“石硫黄(即硫...
高价态的含氧酸酸性强于低价态含氧酸的酸性,那么氧化性呢?比如,亚硝酸的氧化性就强...
...
浓硫酸和浓硝酸都具有氧化性,那么它俩谁更强呢?首先,必须确保同浓度下,水溶剂体系...