
|
学习小专题 |

|
学习小专题 |
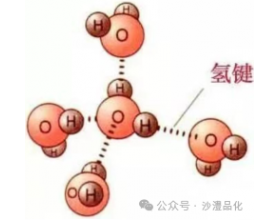 [注解与辨疑e] 有关“分子间氢键”对分子晶体熔沸点的影响问题集 作者:化学自习室 来源:未知 日期:2024-03-13 09:57:36 点击:523 所属专题:氢键与熔沸点
[注解与辨疑e] 有关“分子间氢键”对分子晶体熔沸点的影响问题集 作者:化学自习室 来源:未知 日期:2024-03-13 09:57:36 点击:523 所属专题:氢键与熔沸点
问题①: 第三周期中的几种非金属元素的氢化物的沸点: CH 4 NH 3 H 2 O ,为什么? 【 析 】: CH 4 分子间为范德华力, NH 3 、 H 2 O 有分子间氢键,使其分子间的作用力增大,熔沸点升高。 氢化物 C H 4 NH 3 H 2 O H F 熔点 / ℃ -182.5 -77.7 0 -83.7 沸点 / ℃ -1...
 [注解与辨疑e] 分子极性的判断与比较 作者:化学自习室 来源:未知 日期:2024-03-13 07:14:30 点击:4802 所属专题:分子极性判断
[注解与辨疑e] 分子极性的判断与比较 作者:化学自习室 来源:未知 日期:2024-03-13 07:14:30 点击:4802 所属专题:分子极性判断
一、化学键的极性 分子的极性是由化学键的极性产生的: 非极性键: 成键的两个原子电负性相同,共用电子对不偏移。 极性键:成键的两个原子电负性不同,共用电子对偏移。 成键的两个原子的电负性差越大,键的极性越大;若电负性差超过 1.7 ,可以认为该化学键是离子键;...
 [注解与辨疑e] 羧酸与卤代羧酸的酸性比较---诱导效应 作者:化学自习室 来源:未知 日期:2024-03-13 07:10:07 点击:1576 所属专题:羧酸酸性
[注解与辨疑e] 羧酸与卤代羧酸的酸性比较---诱导效应 作者:化学自习室 来源:未知 日期:2024-03-13 07:10:07 点击:1576 所属专题:羧酸酸性
诱导效应: 由于电负性不同的取代基的影响,使整个分子中成键电子对的电子云按取代基的电负性所决定的方向发生偏移的效应叫做诱导效应。 诱导效应分为吸电子诱导效应(如卤素原子)和给电子诱导效应(如烃基)。 p K a=-lg K a ,酸的电离常数 K a 越大, p K a 越...
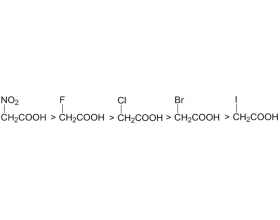 [注解与辨疑e] 羧酸的酸性大小的比较 作者:化学自习室 来源:未知 日期:2024-03-13 07:05:24 点击:1416 所属专题:羧酸酸性
[注解与辨疑e] 羧酸的酸性大小的比较 作者:化学自习室 来源:未知 日期:2024-03-13 07:05:24 点击:1416 所属专题:羧酸酸性
影响脂肪族羧酸酸性的因素: ( 1 )连有 吸电子诱导效应的原子或基团 ,使 酸性增强 ;连有 给电子诱导效应效应的原子或基团 ,使 酸性减弱 。 图 1 吸电子诱导效应 ↓,酸性↓ 图 2 诱导效应具有加和性 图 3 诱导效应与距离成反比 ( 2 )与羧基存在 共轭效应的基团 ...
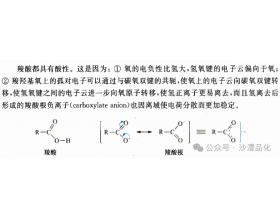 [注解与辨疑e] 为什么苯甲酸的酸性弱于甲酸呢? 作者:化学自习室 来源:未知 日期:2024-03-12 15:58:39 点击:1665 所属专题:羧酸酸性
[注解与辨疑e] 为什么苯甲酸的酸性弱于甲酸呢? 作者:化学自习室 来源:未知 日期:2024-03-12 15:58:39 点击:1665 所属专题:羧酸酸性
酸性强弱的比较 一、 诱导效应和共效应 诱导效应: 一般存在于 σ 键中,通过原子间电负性的差异而导致键的极性改变,从而使整个分子电子云发生移动 。诱导效应 属于短距离效应,一般 传递 3 个碳原子后基本消失,其极化变化方向单一。 烷基的诱导作用强弱规律是:碳链...
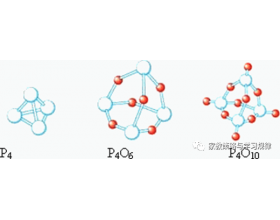 [注解与辨疑e] 氮及其化合物问题集 作者:王笃年 来源:未知 日期:2024-02-03 17:26:35 点击:278 所属专题:氮及其化合物
[注解与辨疑e] 氮及其化合物问题集 作者:王笃年 来源:未知 日期:2024-02-03 17:26:35 点击:278 所属专题:氮及其化合物
1. 作为同一主族且在周期表里相邻的元素,为什么氮元素的单质为 N 2 分子而磷元素的单质则是 P 4 (白磷) ? 与此类似的问题还有很多,如同主族的氧元素和硫元素,其单质分子结构也有很大不同——氧元素的单质有 O 2 和 O 3 等小分子,而常温下硫元素的稳定单质则主要是...
 [注解与辨疑e] 有关氢键问题集 作者:王笃年 来源:未知 日期:2024-02-03 17:01:47 点击:1100 所属专题:氢键
[注解与辨疑e] 有关氢键问题集 作者:王笃年 来源:未知 日期:2024-02-03 17:01:47 点击:1100 所属专题:氢键
1. 氢键是一种怎样的作用力?为什么要特别提出氢键这个概念? “ 氢键 ” 不是化学键,它只是一类较强的分子间作用力。 氢键概念的提出,是科学家在研究物质结构与性质关系的过程中,发现新问题、解决新问题的创造性思维的体现。 让我们以 IVA-VIIA 族元素氢化物沸点( ...
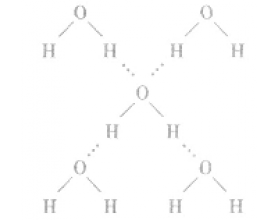 [注解与辨疑e] 氢键的形成条件及特点 作者:化学自习室 来源:未知 日期:2023-12-11 09:42:27 点击:2808 所属专题:氢键
[注解与辨疑e] 氢键的形成条件及特点 作者:化学自习室 来源:未知 日期:2023-12-11 09:42:27 点击:2808 所属专题:氢键
(1)概念: 已经与电负性很大的原子(如N、O、F) 形成共价键的氢原子与另一个电负性很大的原子(如 N、O、F)之问的作用力。如水分子问的氢键如下图所示。 (2)表示方法: A—H…B一(A、B为N、O、F“一” 表示共价键,“…”表示形成的氢键)。 (3)分类 (4)属性: 氢键不属于化学...
 [注解与辨疑e] 复盐、配合物、络合物、螯合物概念辨析 作者:化学自习室 来源:未知 日期:2023-11-16 10:38:39 点击:2561 所属专题:复盐 配合物
[注解与辨疑e] 复盐、配合物、络合物、螯合物概念辨析 作者:化学自习室 来源:未知 日期:2023-11-16 10:38:39 点击:2561 所属专题:复盐 配合物
复盐 在配合物的概念确立以前,人们把所有由两种或两种以上的盐组成的盐都称为复盐(double salt),如 KMgCl3·3H2O(光卤石)、KAl(SO4)2·12H2O(明矾)、Na3AlF6(冰晶石)、Ca5(PO4)3F(磷灰石)、Al2(SiO4)F2(黄玉)等。普遍认为,若一种复盐在其晶体中和在水溶液中都有络离...
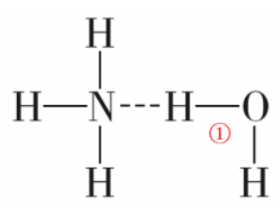 [注解与辨疑9] 氨水中的氢键长啥样? 作者:化学自习室 来源:未知 日期:2023-10-30 11:02:06 点击:1271 所属专题:氨水 氢键
[注解与辨疑9] 氨水中的氢键长啥样? 作者:化学自习室 来源:未知 日期:2023-10-30 11:02:06 点击:1271 所属专题:氨水 氢键
我们在第二章第三节中学习了氢键,知道了HF、NH 3 、和H 2 O之间都能形成氢键,氢键的形式一般表示为X-H···Y。水之间形成的氢键就是H-O···H,氨气和氨气之间的形成的氢键就是N-H···N。那么NH 3 和H 2 O之间形成的氢键是什么呢? 按理来说,应该是有N-H···O...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。1mol 氨中氢键数量分析 一、氢键形成机制 NH分子结构 H原子作为氢键供体(需与高电负性...
二氧化氮(NO)中氮原子的杂化类型为 sp杂化,具体分析如下: 1.计算 n (的价层电子对数...
...
【导读】 以下是快速判定氢键强弱的基本原则,实际案例中经常会进一步考虑综合因素的...
根据价电子互斥理论, ClO 2 中氯原子周围的价电子对数计算为 3.5,理论上应倾向于 sp...
【导读】分子间作用力(范德华力)的来源是取向力、诱导力和色散力。 ①一般情况下,极...
PH3与PF3两者中心原子杂化方式及孤对电子数都相同,F原子的电负性比H的电负性更大,P-...
硫氰根离子(SCN)与金属离子形成配位键时,硫原子和氮原子都有可能给出电子对。 当和一...