
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
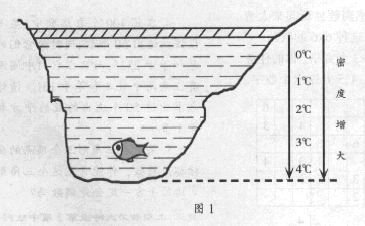
我们知道,正常情况下物质是热胀冷缩的,所以温度越高,物质的密度越小。但也有一些例外情况,如水在0℃~4℃之间是热缩冷胀的,人们把这种现象叫做反常膨胀。设想把一定质量的水从0℃加热到10℃,水的体积是先减小后增大的,4℃是转折点,此时体积最小,密度最大。水的这种奇异特性很容易在自然界中看到,如冬天河塘里的水结冰时,总是从水面开始的。也就是说首先是河面的水温降到0℃,下面的水温则高于0℃,从上向下温度逐渐升高,河底温度在4℃左右;密度则逐渐增大,河底密度最大,如图1所示。正因为水的这种奇异特性,才出现“人在冰上走,鱼在冰下游”的自然景象。
我们的问题是,水为什么会出现反常膨胀现象?或者说,为什么水在4℃时密度最大呢?一般来说,热学中的宏观现象都有它的微观本质,所以水的反常膨胀也跟水分子特殊排列有关。但要从分子论的角度给出详细的解释,困难比较大。到目前为止,人们对水分子的研究还是很不够的,有关水的反常膨胀现象尚没有统一的解释。本文介绍两种常见且通俗的解释,供同学们参考。
解释一
在温度较低时,水中不完全是液态,还有一些微小的冰晶体。在冰晶体中,每个分子以一定的规律排列在晶体点阵内,每个分子都被四个分子所包围,四个分子在空间构成一个四面体。而液态水中的分子,排列比较杂乱,不像冰晶体中的分子那样规则排列。虽然这些水分子在液态水中运动比在冰晶体中更自由些,但是分子间的平均距离却比在冰中小,所以液态水的密度比固态水的密度大。科学家用X射线研究接近0℃的水的结构时,证实在液态水中存在着非常小的冰晶体。根据推算,在接近0℃的水中大约有0.6%的这种冰晶体。当温度逐渐升高时,这些冰晶体逐渐被破坏,引起了体积的减小,致使密度增大。
在温度4℃上下,水中有两种使密度发生改变的效应:一是由于温度升高,液态水的分子热运动加剧,分子间的平均距离增大,致使水的密度减小;另一种是由于温度升高,水中所含有的冰晶体逐渐熔解,分子间的平均距离减小,致使密度增大。在1大气压(101.325千帕)下,水温低于4℃前,后一种效应占优势;而水温高于4℃后,前一种效应占优势。设想一定质量的水,温度从0℃逐渐升高到5℃,根据上面的分析,水的体积将先减小后增大,密度则先增大后减小,在4℃时体积最小,密度最大。实际上,温度越过4℃以后,冰晶体会越来越少,直至消失,水就进入正常膨胀状态了。
解释二
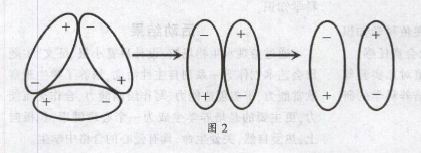
水由不断运动着的水分子组成,而水分子是有极分子,即它的正、负电荷“重心”不重合。在一般情形下,水并不是以单个分子的形式存在的,而是由多个分子相互吸引联在一起的。在0℃时,由三个分子联在一起组成分子团;当温度升高到4℃时,这种组合转化为两个分子联合在一起的分子团,显然两个分子组合的排列要比三个分子组合的排列紧密些;当温度升高到4℃以上时,分子热运动加剧,动能增大,吸引在一起的两个分子又逐渐拆开为单个分子,运动的范围更大了,导致水分子间的平均距离变大,密度减小。这三种状态,可以用图2来示意。所以水在4℃时密度最大。
上面两种观点虽然都解释了水在4℃时密度最大这一现象,但在没有经过实验严格验证之前,只能称为科学假说,理论本身是否正确还有待人们进一步研究。事实上,为解释自然现象而提出假说,再用实验去验证假说,从而得到正确的理论,正是科学探究的一般过程。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一般来说,同主族元素形成的R-R键键能从上至下,键长逐渐增大...
离子极化与影响元素 离子极化理论是离子键理论的重要补充。...
原子之间形成共价键时,若共用电子对只是由一方原子提供电子...
p区元素化学的学习中我们常常发现,很多非金属含氧酸的游离酸...
不是的。 只能提供一对孤对电子与中心原子形成配位键,被称为...
磷的含氧酸共有四种: 磷酸(H 3 PO 4 ),结构式 :三元中强酸...