
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、比值不变,判断反应是否达到平衡
1.反应物与反应物之间物质的量(或者物质的量浓度)的比值不变
如果投料时,反应物物质的量(或者物质的量浓度)的比值等于它们的化学计量数值比,不能判断,
比如对于反应:
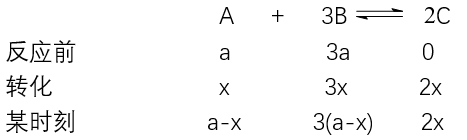
不难发现无论反应程度,A、B的物质的量(浓度)始终为1:3,不变,这是一个常量,不能判断平衡。
反应物物质的量(或者物质的量浓度)的比值不等于它们的化学计量数值比,比值是变量,就可以判断。
A(g)+3B(g) 2C(g),A、B按1:3投料时,当A、B物质的量之比不变时,反应达到平衡。(✘)
2C(g),A、B按1:3投料时,当A、B物质的量之比不变时,反应达到平衡。(✘)
A(g)+3B(g) 2C(g),A、B按3:1投料时,当A、B物质的量之比不变时,反应达到平衡。(✔)
2C(g),A、B按3:1投料时,当A、B物质的量之比不变时,反应达到平衡。(✔)
2.反应物与生成物之间的比值不变
随着反应进行,反应物物质的量(浓度)减少,生成物物质的量(浓度)增加,显然比值是变量,我们就可以据此判断反应处于平衡。
这里需要注意的是,反应物与生成物之间,比值“不变”是关键,比值“等于”化学计量数,是不可以判断是否平衡的。
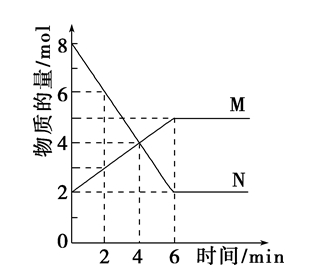
4min时,M和N物质的量相等,4min后不再相等,所以4min时没有平衡。
6min前,M和N比值不断变化,是变量,6min及以后,M和N比值不变,所以反应达到平衡。
A(g)+3B(g) 2C(g),当A、C物质的量之比不变时,反应达到平衡。(✔)
2C(g),当A、C物质的量之比不变时,反应达到平衡。(✔)
A(g)+3B(g) 2C(g),当A、C物质的量之比为1:2时,反应达到平衡。(✘)
2C(g),当A、C物质的量之比为1:2时,反应达到平衡。(✘)
3.反应速率间的比值不变
这个一定要看反应方向,速率一个是正反应,一个是逆反应。
如b的正反应速率等于a逆反应速率的三倍(化学计量数之比),这样才能确定正逆反应速率相等,即达到平衡。
A(g)+3B(g) 2C(g),当速率υ(A)正:υ(B)逆=1:3时,反应达到平衡。(✔)
2C(g),当速率υ(A)正:υ(B)逆=1:3时,反应达到平衡。(✔)
A(g)+3B(g) 2C(g),当速率υ(A):υ(B)=1:3时,反应达到平衡。(✘)
2C(g),当速率υ(A):υ(B)=1:3时,反应达到平衡。(✘)
二.气体分子平均相对分子质量不变,判断反应是否达到平衡
重点是抓住两个公式:
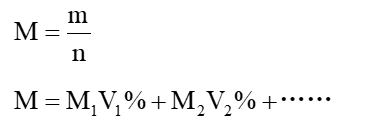
1.反应物产物全是气体
气体总质量m不变,反应前后气体化学计量数之和相等,反应前后气体的物质的量n不变,则m是定值,不能作为判断标志。
如果前后化学计量数之和不等,则可以作为平衡标志。
A(g)+3B(g) 2C(g),混合气体平均相对分子质量不变时,反应达到平衡。(✔)
2C(g),混合气体平均相对分子质量不变时,反应达到平衡。(✔)
A(g)+2B(g) 3C(g),混合气体平均相对分子质量不变时,反应达到平衡。(✘)
3C(g),混合气体平均相对分子质量不变时,反应达到平衡。(✘)
2.有固体参加或生成,前后气体的化学计量数之和相等
气体总质量增加或减小,m是变量;反应前后气体化学计量数之和相等(反应前后气体的物质的量n不变,则m是变量,可以作为判断标志。
A(g)+2B(s) C(g),混合气体平均相对分子质量不变时,反应达到平衡。(✔)
C(g),混合气体平均相对分子质量不变时,反应达到平衡。(✔)
A(g)+2B(g) C(g),混合气体平均相对分子质量不变时,反应达到平衡。(✔)
C(g),混合气体平均相对分子质量不变时,反应达到平衡。(✔)
3.反应物只有固体,产物只有气体
反应物只有固体,则产物各气体的体积分数不变,根据公式可知,m是定值,不能作为判断依据。
A(s) 2B(g)+C(g),混合气体平均相对分子质量不变时,反应达到平衡。(✘)
2B(g)+C(g),混合气体平均相对分子质量不变时,反应达到平衡。(✘)
A(g) 2B(g)+ C(g),混合气体平均相对分子质量不变时,反应达到平衡。(✔)
2B(g)+ C(g),混合气体平均相对分子质量不变时,反应达到平衡。(✔)
三.刚性容器内混合气体密度不变,判断反应是否达到平衡
看公式![]() :,刚性容器V(不变),只需考虑混合气体质量即可
:,刚性容器V(不变),只需考虑混合气体质量即可
1.反应物和生成物全是气体,则容器内气体质量m保持不变,那么气体密度就不改变,因此无法判断是否平衡。
2.方程式中有固体或液体,则m增大或减小,ρ是变量,可以判断平衡。
A(s) 2B(g)+ C(g),混合气体密度不变时,反应达到平衡。(✔)
2B(g)+ C(g),混合气体密度不变时,反应达到平衡。(✔)
A(g) 2B(g)+C(g),混合气体密度不变时,反应达到平衡。(✘)
2B(g)+C(g),混合气体密度不变时,反应达到平衡。(✘)
四.某气体体积分数不变,判断是否达到平衡状态
气体体积分数就是某一气体的物质的量在混合气体中总物质的量的百分数。
核心就在于列出反应在『起,转,平』各气体物质的量分数,进而求解。
1.CO2(g)+3H2(g) CH3OH(g)+H2O(g),投料为1mol CO2(g)和3mol H2(g),CO2体积分数能不能作为判断标志?
CH3OH(g)+H2O(g),投料为1mol CO2(g)和3mol H2(g),CO2体积分数能不能作为判断标志?
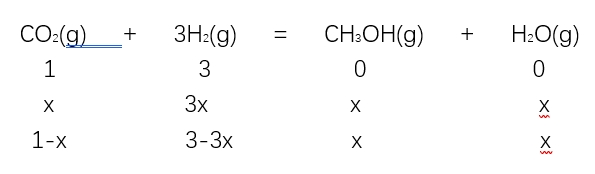
混合前,CO2体积分数为25%
混合后任意时刻,CO2的体积分数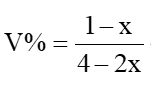 是个变量,可以作为判断依据。
是个变量,可以作为判断依据。
2.CO2(g)+3H2(g) CH3OH(g)+H2O(g),投料为1mol CO2(g)和1mol H2(g),CO2体积分数能不能作为判断标志?
CH3OH(g)+H2O(g),投料为1mol CO2(g)和1mol H2(g),CO2体积分数能不能作为判断标志?
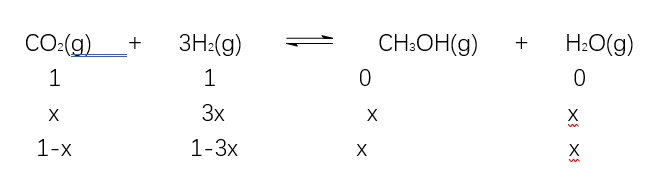
混合前,CO2体积分数为25%
混合后任意时刻,CO2的体积分数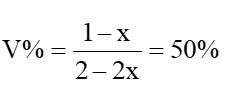 ,是个定值,不可以作为判断依据。
,是个定值,不可以作为判断依据。
类似的还有A(g)+5B(g) 3C(g)+D(g),投料为A:b=1:1时,a的体积分数不能反应达到平衡的判断依据。
3C(g)+D(g),投料为A:b=1:1时,a的体积分数不能反应达到平衡的判断依据。
3.当反应物全是固体,产物有气体生成时,各物质比值一定,体积分数一定,不能作为判断依据。
H2NCOONH4(s) 2NH3(g)+CO2(g),产物NH3的体积分数固定是66.7%,不能作为判断依据。
2NH3(g)+CO2(g),产物NH3的体积分数固定是66.7%,不能作为判断依据。
再看一遍以上几道题,可以发现几乎每道题都标出了投料的多少,这是由于投料的多少确定了气体在初始状态下的体积分数,也决定了他的体积分数是否变化。那么解决这类问题,就要列出起始状态、转化时、平衡状态时各气体物质的量求出体积分数,判断它是定值还是变常量。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、比值不变,判断反应是否达到平衡 1 .反应物与反应物之间物质的量(或者物质的量浓...
在中学阶段,掌握燃料电池的工作原理和电极反应式的书写是十分重要的。所有的燃料电池...
在化学平衡的计算中,常常要计算反应物的转化率、各组分的转化浓度、转化的物质的量、...
如何判断一个化学反应是否已达平衡,方法很多,本文总结如下,供大家参考。 一、根据...
一.燃料电池介绍 燃料电池是一种主要通过氧气或其他氧化剂进行氧化还原反应,把燃料...
原电池有两个电极,一个是正极,一个是负极,其判断的依据有: 1.据组成原电池的两极...