化学键是重要的基本概念。为了便于大家学习《化学键》的知识,熟练掌握有关化学键内容的解题方法,本文以分类加例题的形式与大家共同探讨几类与之相关的试题。 一、化学键的相关概念 例1. 下列有关化学键的叙述正确的是( ) A. 化学键既存在于相邻的原子之间,又存在
化学键是重要的基本概念。为了便于大家学习《化学键》的知识,熟练掌握有关化学键内容的解题方法,本文以分类加例题的形式与大家共同探讨几类与之相关的试题。
一、化学键的相关概念
例1. 下列有关化学键的叙述正确的是( )
A. 化学键既存在于相邻的原子之间,又存在于相邻的分子之间
B. 两个原子之间的相互作用叫做化学键
C. 化学键通常指的是相邻的两个或多个原子之间强烈的相互作用
D. 阴、阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距相当小
解析:化学键的定义中有两点值得我们注意:一是“相邻的原子之间”;二是“强烈的相互作用”。选项A不满足第一点,选项B没有“强烈的”三个字,所以选项A、B都不正确,选项C正确。当阴离子和阳离子形成离子键时,不但有这两种相反电荷的吸引作用,而且也存在两种离子的核外
电子云之间、两种离子的原子核之间的排斥作用,吸引与排斥平衡。选项D认为阴、阳离子之间有强烈的吸引作用而忽略了排斥作用,选项D不正确。
答案 C
二、化学键种类的判断
例2. 下列化学反应中,既有离子键、极性键、非极性键的断裂,又有离子键、极性键、非极性键形成的是( )
A.
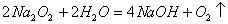
B.
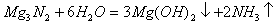
C.
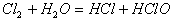
D.
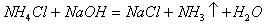
解析:对于选项A,
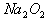
在化学反应中既有离子键又有非极性键的断裂,H
2O有极性键的断裂,产物NaOH既有离子键又有极性键的形成,O
2体现了非极性键的形成,符合题意。选项B、D中的反应物均不含非极性键,即不可能有非极性键的断裂。选项C的反应物中,根本不含离子键,亦可排除。
答案:A
三、化学键的形成
例3. A、B、C、D均是短周期元素。当A、B两元素的原子分别得到两个电子形成稳定结构时,A放出的能量大于B放出的能量;当C、D两元素的原子分别失去一个电子形成稳定结构时,D吸收的能量大于C吸收的能量。若A、B、C、D四种元素间分别形成化合物时,属于离子化合物可能性最大的是( )
A. C2A B. C2B
C. D2A D. D2B
解析:由题意可知:
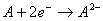
,放出能量较大;
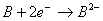
,放出能量较小,即A得电子能力强,故A的非金属性比B强。C原子失去最外层1个电子比D原子失去最外层1个电子,外界提供的能量少,易知C的金属性比D活泼。根据以上分析可知,较活泼的金属和较活泼的非金属形成的化合物C
2A,属于离子化合物的可能性最大。
答案:A
四、化学键的断裂
例4. 下列分子中最难分裂成原子的是( )
A. HF B. HCl C. HBr D. HI
解析:以上分子要分裂成原子必须破坏H—X键。共价键的
键能越大,键越难于断裂。对于这种共价单键,键能大小与原子半径大小相关。四种卤原子中,氟的原子半径最小,氢与氟核间距离最短,结合最牢,该键最难断裂。
答案:A
五、电子式的书写
例5. 下列粒子的结构表示正确的是( )
A.
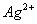
的电子式:
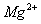
B.
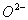
的结构示意图:
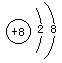
C.
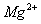
的电子式:
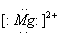
D.
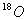
的结构示意图:
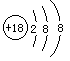
解析:本题考查的是阳离子电子式和粒子结构示意图的书写。Mg原子失去最外层的两个电子后,最外层已经没有电子,
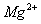
的电子式即为其离子符号,选项A正确,C错误。
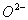
核电荷数为8,核外有10个电子,选项B正确,
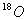
核电荷数为8,核外有8个电子,质量数为18,选项D错误。
答案:AB
六、电子式表示物质的形成过程
例6. 用电子式表示下列物质的形成过程
解析:用电子式表示离子化合物的形成过程要注意:对于阳离子,一般用离子符号表示(
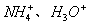
等除外),而阴离子则不同,在元素符号周围一般用小黑号(或×)表示最外层电子数,外面再加“[]”,并在“[]”右上方标上所带负电荷数。用电子式表示共价化合物或某些非金属单质的形成过程要注意:①共价化合物的电子式中,要注意使每个原子周围的电子数均达到稳定结构。②由于共价化合物中没有阴阳离子,所以用电子式表示共价化合物的结构时,不使用中括号,也不标电荷数。
答案:
③
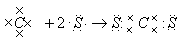
(责任编辑:化学自习室)


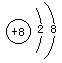
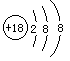
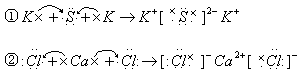

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。