
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.概述
(1) 位置及其原子结构
位置:位于元素周期表的右上角。把6种稀有气体除外,一般所指的非金属元素就只有16种。
原子结构:最外层电子数较多,原子半径较小,化学反应中容易结合电子,显示负化合价。
(2) 单质的晶体类型
分子晶体:H2、X2、O2、O3、S8、N2、P4、稀有气体。
原子晶体:金刚石、Si、B。
(3) 单质的同素异形体
氧族、卤族及氮没有同素异形体。
由同种原子组成的晶体,晶格不同,形成不同的单质。如金刚石和石墨。
由同种原子组成的分子,其原子个数不同,形成不同的单质。如O2、O3。
由同种原子组成的分子,其晶格不同,原子个数也不同而形成不同的单质。如白磷和红磷。
2.单质的物理性质
(1) 常温常压下非金属单质的状态
属于分子晶体的,在同类单质中分子量较小(范氏力较小)为气态(F2、Cl2、O2、N2、H2),较大的为液态(Br2),固态(S、P、I2)。
属于原子晶体的是固态(金刚石、硅、硼)。
(2) 单质的熔、沸点
属于分子晶体的由于分子间力较小,故熔、沸点较低。具有相似结构的同类晶体中,一般是分子量越大,其熔、沸点较高。
属于原子晶体的由于共价键的键能大,牢固,所以熔点很高,如金刚石,硬度大。
(3) 水溶性
氟能与水剧烈反应生成HF和O2;氯能溶于水(歧化反应),难溶于饱和食盐水;其它单质的水溶性都很小。
(4) 非金属单质呈固态时有热脆性,可能透明或半透明。
比重较小,无金属光泽((石墨例外)。导电、导热性差。
3.非金属单质的化学性质
(1) 化学惰性:稀有气体;
强氧化性:F2、Cl2、Br2、O2;
以还原性为主:H2、C、Si、B、P、As。
(2) 典型的非金属较易跟金属化合,一般形成离子键,非金属元素得电子,呈负价。
(3) 典型的非金属能跟氢气以极性共价键化合生成气态氢化物(ⅣA—ⅦA),共用电子对偏向非金属元素,非金属元素显负价。
(4) 不同非金属间通过极性键形成化合物,共用电子对偏向吸电子能力强的非金属。
(5) 非金属氧化物一般为酸性氧化物,其对应的水化物是酸,最高价氧化物对应的水化物酸性越强,则其元素的非金属性也越强。
具体化学性质是:
(1) 与金属反应
绝大多数非金属能与金属直接化合生成盐、氧化物、氮化物和碳化物。反应的难易是:强强易,弱弱难。典型的金属与典型的非金属化合形成离子化合物。
2Na+Cl2=2NaCl
3Fe+2O2![]() Fe3O4
Fe3O4
3Mg+N2![]() Mg3N2
Mg3N2
金属活动顺序表里的金属都能与F2、Cl2反应,除Ag、Pt、Au外都能与Br2、I2反应,除Pt、Au外都能与S反应,以上均生成无氧酸盐。
注意:2Na+S=Na2S,Hg+S=HgS较易。
(2) 与非金属反应
① 与H2反应生成气态氢化物(以极性键形成气态氢化物,水是液态)。反应的难易是:强易弱难,强稳定。
即使在温度
H2+Cl2![]() 2HCl
2HCl
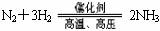
非金属气态氢化物大多具有还原性,其规律是:强者弱。
② 与O2反应生成非金属氧化物,除NO、CO外,皆为成盐氧化物。反应规律是强难弱易,卤素不与氧气直接化合,具有强还原性的非金属与氧气反应容易。大多数非金属氧化物是酸性氧化物,其最高氧化物中除CO2为气体外,其余皆为固体。
S+O2=2SO2 4P+5O2=2P2O5
非金属单质形成氧化物的由易到难的程度:P、S、C、Si、N、I、Br、Cl。
40℃左右白磷燃烧,300℃左右煤(C)着火。C、Si可在空气中烧尽,N2在2000℃左右才和氧气化合。I2、Br2、Cl2不与氧气直接化合。
③ 与其它非金属反应
2P+3Cl2=2PCl3
2P+5Cl2=2PCl5
Si+2F2=SiF4
C+2S![]() CS2
CS2
(3) 与水反应
2F2+2H2O=4HF+O2(置换)
Cl2+H2O=HCl+HClO(Br2、I2相同)(歧化)
C+H2O(g)![]() CO+H2 (水煤气)
CO+H2 (水煤气)
(4) 与碱溶液反应
X2+2NaOH(稀)=Nax+NaXO+H2O(注意:F2例外)
3X2+6NaOH(浓)=5Nax+NaXO3+3H2O(注意:F2例外)
3S+6KOH(浓)=2K2S+K2SO3+3H2O
Si+2NaOH+H2O=Na2SiO3+2H2
P4+3NaOH+3H2O 3NaH2PO2+PH3
3NaH2PO2+PH3
(5) 与氧化性酸反应
不太活泼的非金属C、S、P、I2等具有较强还原性,可被硝酸和浓硫酸等强氧化性酸氧化。
C+2H2SO4(浓) CO2+2SO2+2H2O
CO2+2SO2+2H2O
C+4HNO3(浓) CO2+4NO2+2H2O
CO2+4NO2+2H2O
S+2H2SO4(浓) 3SO2+2H2O
3SO2+2H2O
S+6HNO3(浓) H2SO4+6NO2+2H2O
H2SO4+6NO2+2H2O
P+5HNO3(浓) H3PO4+5NO2+H2O
H3PO4+5NO2+H2O
P(白磷)+5HNO3(稀)+2H2O=3H3PO4+5NO
I2+10HNO3(浓)=2HIO3+10 NO2+4H2O
(6) 与氧化物反应
① 与金属氧化物反应(具有还原性的非金属与具有氧化性的金属氧化物发生氧化还原反应。)
C+2CuO CO2↑+2Cu
CO2↑+2Cu
C+FeO![]() CO↑+Fe
CO↑+Fe
Si+2FeO![]() SiO2+2Fe
SiO2+2Fe
H2+CuO H2O↑+Cu
H2O↑+Cu
Na2O+O2=Na2O2
② 与非金属氧化物反应
C+H2O![]() CO+H2
CO+H2
2C+SiO2![]() 2CO↑+Si
2CO↑+Si
3C+SiO2![]() 2CO↑+SiC
2CO↑+SiC
2F2+2H2O=4HF+O2
C+CO2![]() 2CO
2CO
2SO2+O2=2SO3
2NO+O2=2NO2
(7) 与无氧化酸及无氧酸盐反应
按非金属的活动顺序发生置换反应(强代弱)。
2NaBr+Cl2=2NaCl+Br2
Br 2+2NaI=2NaBr+I2
Cl2+Na2S=2NaCl+S¯
2H2S+O2=2H2O+2S
2H2S+3O2![]() 2H2O+2SO2
2H2O+2SO2
4.非金属单质的制备方法
(1) 氧化阴离子法
电解法(可制取Cl2、F2、O2等)
2NaCl![]() 2Na+Cl2
2Na+Cl2
 (电解KHF2,Cu作容器、阴极,石墨作阳极,2KHF2
(电解KHF2,Cu作容器、阴极,石墨作阳极,2KHF2![]() 2KF+H2+F2)
2KF+H2+F2)
用强氧化剂氧化
2KMnO4(浓)+16HCl(浓) 2KCl+2MnCl2+Cl2+8H2O
2KCl+2MnCl2+Cl2+8H2O
4HCl(浓)+MnO2 MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O
2NaI+Cl2=2NaCl+I2 H2S+Br2=2HBr+S¯
(2) 氧化负价原子(热分解法)
2KMnO4 KMnO4+MnO2+O2
KMnO4+MnO2+O2
2H2S+O2(不足)![]() 2S+2H2O
2S+2H2O
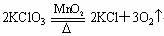

CH4+O2![]() (不足)C+2H2O
(不足)C+2H2O
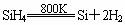
(3) 还原正价元素:用强还原剂将不太活泼的非金属从它们的化合物中还原出来,这种反应需要在高温下进行。
SiCl4+2H2![]() Si+4HCl
Si+4HCl
B2O3+3H2![]() 2b+3H2O
2b+3H2O
P2O5+C![]() 2P+5CO
2P+5CO
2C+SiO2![]() 2CO↑+Si
2CO↑+Si
2Mg+SiO2![]() 2MgO+Si
2MgO+Si
Zn+2HCl=ZnCl2+H2
其它: NH4Cl+NaNO2 NaCl+2H2O+N2
NaCl+2H2O+N2

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
锰(Mn)是元素周期表第四周期第 ⅦB 族的过渡金属元素,原子...
镁(Mg,原子序数 12,第 ⅡA 族碱土金属元素)是典型的活泼金...
在第ⅡA族(碱土金属)元素家族中,铍(Be)以其极致的轻金属特性、...
1.皓矾: ZnSO 4 ·7H 2 O 2.钡餐,重晶石: BaSO 4 3.绿矾,皂矾,青矾...
少量、适量、足量和过量,这几个词是化学实验和计算中的核心...
一、基础概念:从 “温度强度” 看五者的核心差异 首先需明确...