
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
EDTA(Ethylenediaminetetraacetic acid,乙二胺四乙酸)是一种具有广泛应用价值的有机化合物,被誉为 “万能螯合剂”。其化学分子式为C₁₀H₁₆N₂O₈,分子量为292.24,化学结构中包含两个氨基(-NH-)和四个羧基(-COOH),形成对称的五元环骨架。
所谓螯合:EDTA可以牢固地结合金属离子,形成络合物,使金属离子失去反应活性。
1、EDTA结构特点
其分子结构像一个“四臂螯蟹”。中心是一个乙二胺基团(-N-CH₂-CH₂-N-),两端各连接两个乙酸基团(-CH₂-COOH)。这四个羧酸基团和两个氮原子提供了六个配位点,可以像蟹钳一样牢牢抓住金属离子。
在常温下,EDTA 为白色结晶性粉末,无臭、无味,难溶于冷水,易溶于热水和碱性溶液,微溶于乙醇、丙酮等有机溶剂。由于游离 EDTA 水溶性较差,实际应用中多采用其盐类衍生物,其中最常用的是乙二胺四乙酸二钠(EDTA-Na₂・2H₂O)和乙二胺四乙酸二钾(EDTA-K₂),二者水溶性显著提升。

2、螯合作用机制
EDTA的螯合作用是典型的多齿配位反应,其机制核心在于分子结构与金属离子的电子构型互补及热力学稳定化效应。
作为六齿螯合剂,EDTA的6个配位原子,各原子均含未参与成键的孤对电子,可作为 Lewis 碱提供电子对。
金属离子(如Ca²⁺、Mg²⁺、Fe³⁺)的价层电子轨道(如 sp³d² 杂化轨道)存在空穴,作为 Lewis 酸接受电子对,与 EDTA 的配位原子形成配位键。
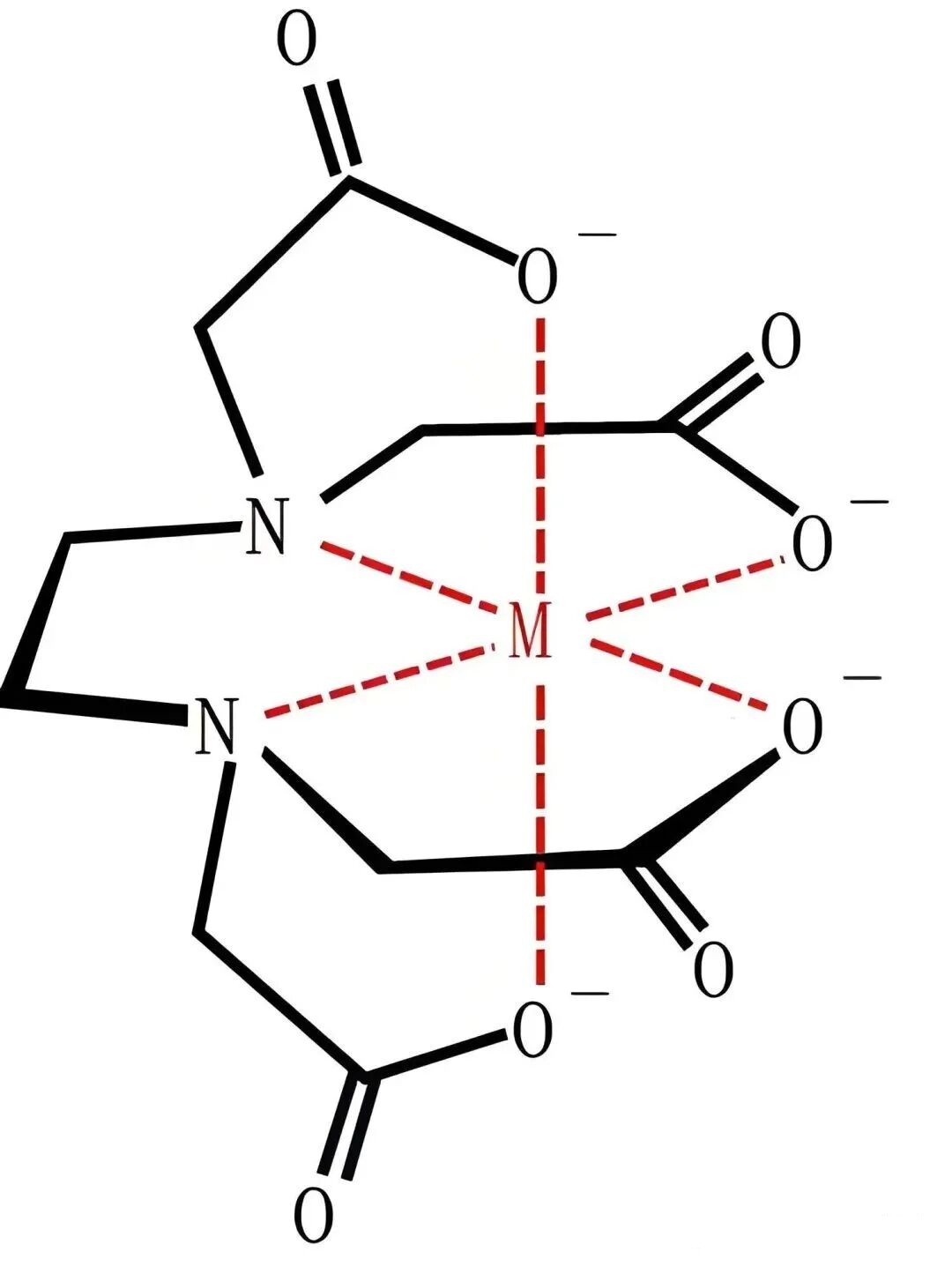
EDTA在水溶液中通过构象折叠,使 6 个配位原子同步朝向金属离子,形成立体笼状结构,孤对电子填入金属离子空轨道,构建5个稳定的五元螯合环(热力学最优环结构),实现多齿协同配位。
3、EDTA用量
EDTA 抑制金属离子的核心规律是与金属离子以 1:1 摩尔比螯合,用量需略高于体系中目标金属离子浓度。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
冠醚是一类大环多醚化合物,其分子结构呈环状,环上均匀分布...
在高考备考化学试卷里,经常会遇到含钯的催化剂。本文将就钯...
在离子晶体中存在离子极化现象,使得离子键带有一定共价键的...
【情境】:你注意到我们每天都离不开的水有什么反常之处吗?...
氢键的大小(强度)可以通过多种因素来比较,这些因素包括氢键...
...