
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
配合物的稳定性是指配离子(如 [Cu(NH₃)₄]²⁺)在溶液中解离成中心离子(Cu²⁺)和配体(NH₃)的难易程度。解离越难,配合物越稳定。关于配合物的稳定性,常从热力学稳定性和动力学稳定性两个角度进行阐述。
一、 热力学稳定性
热力学稳定性是指配合物在达到化学平衡状态时的稳定程度,通常用稳定常数Kₛ 来定量表示。对于配合反应:
Mᵐ⁺ + n Lˡ⁻ ⇌ [MLₙ]⁽ᵐ⁻ⁿˡ⁾⁺
其稳定常数 Kₛ 或累积形成常数 βₙ 定义式为:
Kₛ= βₙ = [ [MLₙ]⁽ᵐ⁻ⁿˡ⁾⁺ ] / ( [Mᵐ⁺] · [Lˡ⁻]ⁿ )
Kₛ 值越大,表示配合物越稳定。平衡常数的值越大,表示配合反应进行得越彻底,配合物越稳定,故又称之为K稳 。
示例1:[Ag(CN)₂]⁻和[Ag(NH₃)₂]⁺
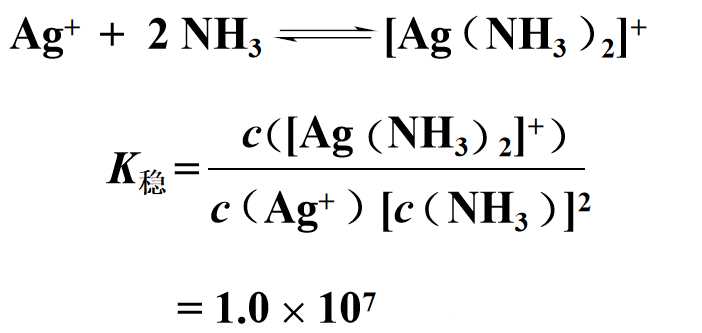
![]()
依据图片中K稳数值可知:[Ag(CN)₂]⁻比[Ag(NH₃)₂]⁺稳定。
热力学稳定性的主要影响因素有中心金属离子的性质、配体的性质和其他效应等。
1.中心金属离子的性质
(1)金属离子的电荷和半径
中心离子的电荷越高、半径越小,其静电吸引力越强,对配体的吸引也越强,形成的配合物越稳定。
示例2: 稳定性由大到小的顺序为: [AlF₆]³⁻ >[MgF₄]²⁻ > [NaF₂]⁻。
Al³⁺电荷最高,半径小,故最稳定。
(2)金属离子的电子构型
具有18电子构型(如 Zn²⁺, Cd²⁺, Hg²⁺)或(18+2)电子构型(如 Pb²⁺, Sn²⁺)的离子,以及9~17电子构型(过渡金属离子)的离子,由于存在较强的极化作用和变形性,能形成稳定的共价配键,通常比8电子构型的离子形成的配合物稳定。
示例3: [HgI₄]²⁻ 非常稳定,而 [Ca(EDTA)]²⁻ 的稳定性则主要靠静电作用。
d³ (如 Cr³⁺)、d⁸ (如 Ni²⁺)、d⁶ (如 Co³⁺) 的配合物特别稳定。
关于第一过渡系二价金属离子配合物稳定性有个普遍顺序Irving-Williams series,
Irving-Williams顺序指的是,对于由同一种配体与第一过渡系二价金属离子形成的八面体配合物,其热力学稳定性遵循一个普遍且固定的顺序:
Mn²⁺ < Fe²⁺ < Co²⁺ < Ni²⁺ < Cu²⁺ > Zn²⁺
①这个顺序描述的是啥?
这个顺序描述的是配合物的稳定常数(Ks)的大小。也就是说,在相同条件下,与同一种配体(例如乙二胺 en、EDTA等)配位时,[NiL] 的稳定性总是高于 [CoL],而 [CoL] 又总是高于 [FeL],以此类推。
②这个顺序的成因是啥?
这个顺序是以下两个主要因素共同作用的结果:
a) 离子半径的减小
从左到右跨越一个周期(从 Mn²⁺到 Zn²⁺),核电荷数增加,而电子是填充在的内层的3d轨道上,对外层电子屏蔽不完全,导致有效核电荷增加。这使得金属离子的离子半径逐渐减小。
更小的离子半径意味着金属离子与配体之间距离更近,静电吸引力更强,从而稳定性更高。
b) 晶体场稳定化能(CFSE)
这是最关键的因素。在八面体场中,不同d电子构型的金属离子会获得不同的CFSE。
Mn²⁺ (d⁵): 在高自旋状态下,电子均匀分布在所有d轨道,CFSE = 0。这是最不稳定的原因之一。
Fe²⁺ (d⁶): 具有较小的CFSE。
Co²⁺ (d⁷): CFSE 比 Fe²⁺ 更大。
Ni²⁺ (d⁸): 具有很高的CFSE,因此稳定性显著提高。
Cu²⁺ (d⁹): 虽然CFSE本身不高,但它会发生姜-泰勒效应。这导致八面体结构发生畸变,使其中一个金属-配体键显著缩短,从而获得额外的稳定化能,使其稳定性甚至超过Ni²⁺。
Zn²⁺ (d¹⁰): d轨道全满,CFSE = 0,因此稳定性突然下降。
③这个顺序有多“普遍”?
Irving-Williams 顺序的惊人之处在于它的普适性。只要配体是“正常的”σ给电子体(如 NH₃、H₂O、乙二胺等),并且形成的是八面体构型,这个顺序几乎总是成立。它不依赖于配体的具体性质(除非配体非常特殊,能形成极强的π反馈键)。
您可以将 Irving-Williams 顺序理解为过渡金属配合物的一个“自然定律”。它源于原子结构的根本性质(有效核电荷和d电子构型)。
记忆口诀:“猛铁钴镍铜锌”,稳定性依次递增,到铜达到顶峰,然后锌下降。
Mn²⁺ < Fe²⁺ < Co²⁺ < Ni²⁺ < Cu²⁺ > Zn²⁺
这个顺序在解释生物体内金属酶的选择、分离金属离子、以及配位化学的许多现象中都具有基础性的重要性。例如,为什么生物体更多选择 Fe²⁺、Co²⁺、Ni²⁺、Cu²⁺ 作为活性中心,而很少用 Mn²⁺ 和 Zn²⁺ 来做与配体强度直接相关的催化,都可以从这个顺序中找到部分答案。
注:这个概念是以两位化学家 Hubert Irving (欧文)和 Robert Williams (威廉姆斯)的名字命名的。他们在1953年通过实验总结并提出了这一规律。
2. 配体的性质
主要是配体碱性、螯合效应、空间位阻和反馈π键等。
(1)碱性:
对于同类型的配体,其碱性越强(给电子能力越强),通常形成的配合物越稳定。
(2)螯合效应:
这是最重要的因素之一。多齿配体(一个配体有多个原子可提供孤对电子)形成的螯合物,比组成和结构相似的单齿配体形成的配合物稳定得多。形成的螯环越多、越大(通常是五元环或六元环最稳定),稳定性越高。
原因:主要是熵增驱动。反应后系统内粒子总数增加,混乱度增大(ΔS > 0),根据 ΔG = ΔH - TΔS,使得 ΔG 更负,反应更易进行。
如:EDTA(六齿配体)能与绝大多数金属离子形成极其稳定的螯合物,广泛应用于分析化学和工业中。
示例4:[Cu(en)₂]²⁺ 比 [Cu(NH₃)₄]²⁺ 稳定得多
(3)大环效应
大环多齿配体(如卟啉、冠醚)形成的配合物比具有相同配位原子数的链状螯合剂形成的配合物更稳定。如:血红素 Fe²⁺-卟啉配合物
(4)空间位阻:
如果配体体积过大,可能会妨碍其与中心离子的有效配位,从而降低稳定性。
(5)反馈π键
金属的d电子可以反馈到配体的空π*轨道上,形成额外的化学键,极大地增强稳定性。
如:Ni(CO)₄ 中反馈π键,使之稳定性。
3. 溶液的酸碱度(pH值)
很多配体是弱酸根离子(如 F⁻, CN⁻, CO₃²⁻)或碱性分子(如 NH₃)。
溶液酸性过强时,H⁺会与配体结合,生成弱酸(如 HF, HCN),使配体浓度下降,导致配合物解离。这称为酸效应。
溶液碱性过强时,某些金属离子会生成氢氧化物沉淀,导致中心离子浓度下降,配合物被破坏。
4. 软硬酸碱理论
这是一个非常有用的经验规则:
硬酸: 电荷高、半径小、不易极化的中心离子(如 Li⁺, Na⁺, Mg²⁺, Al³⁺, Ti⁴⁺)。
软酸: 电荷低、半径大、易极化的中心离子(如 Cu⁺, Ag⁺, Au⁺, Hg²⁺, Pt²⁺)。
硬碱: 电负性高、难极化、难被氧化的配位原子(如 F⁻, O²⁻, OH₂, NH₃ 中的 N, ROH)。
软碱: 电负性低、易极化、易被氧化的配位原子(如 I⁻, CN⁻, CO, S²⁻, R₂S)。
规则:“硬亲硬,软亲软,硬软结合不稳定”。
示例5:
硬酸-硬碱: Al³⁺(硬酸)与 F⁻(硬碱)形成的[AlF₆]³⁻,很稳定;
软酸-软碱: Ag⁺(软酸)与 CN⁻(软碱)形成的 [Ag(CN)₂]⁻,非常稳定;
硬酸-软碱/软酸-硬碱: 如 Hg²⁺、Ag⁺(软酸)与 F⁻(硬碱)形成的配合物HgF₂、 AgF, 不稳定。
示例6: 向 AgF 溶液中顺序加入盐酸、氨水等溶液,反应如下图所示,请说明原因。
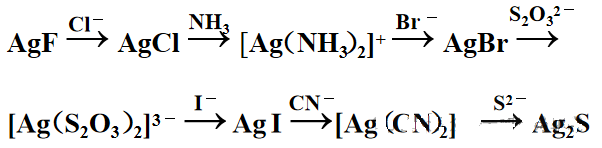

总结:

二、动力学稳定性
动力学稳定性是指配合物发生配体交换或离解反应的速率快慢。
惰性配合物 vs 易变配合物:
1.惰性配合物:配体交换反应速率很慢。例如, [Co(NH₃)₆]³⁺ 在水溶液中离解非常慢。
2.易变配合物:配体交换反应速率很快。例如, [Ni(H₂O)₆]²⁺ 中的水分子交换速率极快。
影响因素:主要取决于反应路径的活化能。d³、低自旋 d⁵、d⁶ 和 d⁸ 构型的金属离子通常形成惰性配合物,因为它们的离解需要克服很高的CFSE能垒。
三、 实际应用
电镀:使用 [Ag(CN)₂]⁻ 等稳定配合物,控制金属离子浓度,获得致密镀层。
生物体系:血红蛋白(血红素 Fe²⁺ )可逆载氧,其稳定性至关重要。
水处理与解毒:EDTA ([Ca(edta)]²⁻) 络合重金属离子可用于络合、去除重金属离子。
医学:顺铂 [PtCl₂(NH₃)₂] 作为抗癌药物,利用其动力学惰性实现靶向抗癌。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
冠醚是一类大环多醚化合物,其分子结构呈环状,环上均匀分布...
在高考备考化学试卷里,经常会遇到含钯的催化剂。本文将就钯...
在离子晶体中存在离子极化现象,使得离子键带有一定共价键的...
【情境】:你注意到我们每天都离不开的水有什么反常之处吗?...
氢键的大小(强度)可以通过多种因素来比较,这些因素包括氢键...
...