
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、电化学腐蚀:
实验原理:

审题点1:看腐蚀类型是否正确
示例:下述装置能否探究铁的析氢腐蚀?
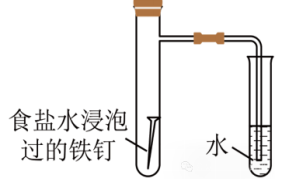
答:×
解析:析氢腐蚀的介质为酸性较强的电解质,食盐水为中性,Fe发生吸氧腐蚀。
审题点2:氢后金属不论环境的酸碱性,只发生吸氧腐蚀
示例:下述装置能否探究铜的析氢腐蚀?

答:×
解析:如果发生了析氢腐蚀,则总反应式是:铜单质与盐酸反应,但我们知道二者实际上并不能发生反应
其正极反应式为:
二、电化学防护:
防护原理:
牺牲阳极法:应用原电池原理,让被保护金属作正极,另找一种活泼性较强的金属作负极
外加电流法:利用电解原理,把被保护的设备作为阴极,用惰性电极作为辅助阳极,两者均放在电解质溶液里,外接直流电源。
审题点1:验证牺牲阳极法时,看被保护金属是否作正极
示例:下述装置能否用于验证牺牲阳极法(保护Fe)?
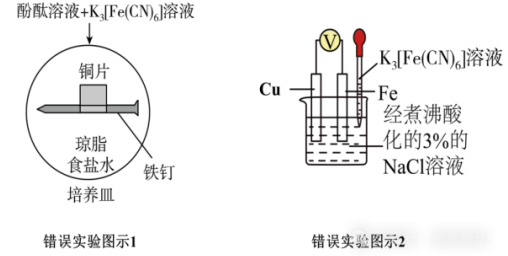
答:×
解析:两个装置中Fe的活泼性比Cu更强,因而Fe作负极,无法对Fe起到保护作用。
拓展分析一下,实验图示1当中的实验现象:铁钉作负极,失去电子转变为亚铁离子,所以,铁钉附近我们可以观察到蓝色固体生成(亚铁离子与铁氰化钾发生作用);铜片作正极,氧气得到电子生成氢氧根离子,因而,铜片附近会变红。(见下图)
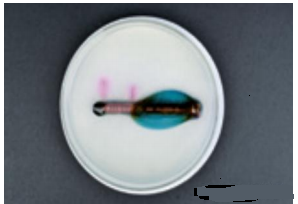
引申拓展:
下述装置能否用于验证牺牲阳极法(保护Fe)?
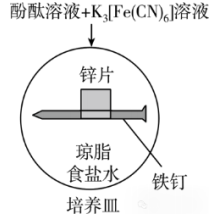
答:√
解析:装置中Zn的活泼性比Fe更强,因而Zn作负极,Fe作正极被保护。
实验现象:Fe电极附近发生如下反应:
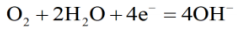
铁钉电极生成氢氧根离子,所以可以观察到铁钉附近变红。
审题点2:验证牺牲阳极法时,看选择的检测试剂是否是铁氰化钾
示例:下述装置能否用于验证牺牲阳极法(保护Fe)?
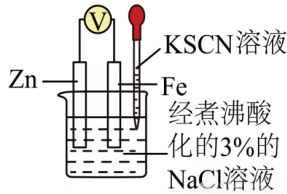
答:×
解析:Fe若被腐蚀,失去电子后会生成Fe2+,不应该使用KSCN溶液进行检验,可以使用铁氰化钾溶液检验Fe2+。
审题点3:验证牺牲阳极法时,看是否将Fe电极附近的溶液取出来进行检测
示例:下述装置能否用于验证牺牲阳极法(保护Fe)?
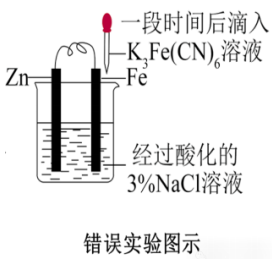
答:×
解析:Zn比Fe活泼,作负极,铁被保护,加入铁氰化钾溶液后,在铁表面没有生成蓝色沉淀,才能说明溶液中并没有Fe2+存在。但是铁氰化钾中的Fe(Ⅲ)可能会氧化Fe单质生成Fe2+,因此不能作出Zn是否能对Fe起到保护作用的判断。
审题点4:验证外加电流法时,看是否将被保护金属作阴极
示例:下述装置能否用于验证外加电流法(保护Fe)?
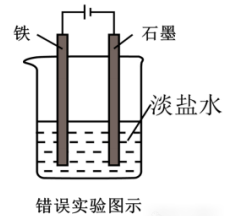
答:×
解析:Fe作阳极会失电子,所以无法起到保护作用。
引申拓展:电化学腐蚀速率大于化学腐蚀速率
选择性必修1教材实验:(2)取两支试管,分别放入两颗锌粒和等体积、等浓度的稀盐酸,观察现象。然后,向其中一支试管中滴加1~2滴硫酸铜溶液,再观察现象。解释产生不同现象的原因
答:滴加硫酸铜以后,锌置换出铜,构成铜锌稀盐酸原电池,化学反应速率加快。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
常见的氯化钾琼脂块盐桥制作方法有三种: 一、用于全固态硝酸...
理论上,在 Cu-Zn 单液原电池中,溶液中的 H + 在 Cu 电极表面...
从电解CuCl 2 溶液的过程来分析,无论是CuCl 2 的浓溶液,还是稀...
...
电解过程中伴随着电能转化为化学能,同时也会产生热能,温度...
一.电解Na 2 SO 3 溶液 【分析】溶液中存在的离子有H + 、OH -...