
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
所谓电化腐蚀,是指金属在电解质溶液中产生了电流现象的一种腐蚀。也是化学能变为电能的过程,它是氧化—还原反应。原电池是将化学能转变为电能的一种装置。即在电解质溶液中的二种不同金属(其中一种也可以是非金属例如碳),较活泼的金属作为负极,产生氧化反应,另一种金属(或非金属)作为正极,产生还原反应,电子从负极流向正极,这个过程称为原电池原理。
问题来源于中等师范学校教科书(试用本)化学第2册第8章电解质溶液第3节原电池原理及其应用的“二、金属的腐蚀和防护”, 即第42页第3~13行这一段。
[实验8—3]在一支试管中加入约3mL稀硫酸, 再放入一块较纯的锌粒。观察气体产生的速率。
[实验8—4]用一根铜丝插入上述试管和锌粒接触,观察气泡产生的速率。
[实验8—5]在上述试管里滴加几滴硫酸铜溶液观察气泡产生的速率。
我们可以看到纯锌与硫酸的反应速率较慢;当铜丝和锌粒接触时,实际上就形成了一个原电池,反应速率加快;当加入硫酸铜溶液后,锌把硫酸铜里的铜置换出来,铜粉覆盖在锌片上就形成了无数个微小的原电池,大大加快了氢气的生成速率和锌粒被腐蚀的速率。
显然,上述的教学内容,是用3个实验,产生了3个不同反应速率的实验现象,论证了一个事实:金属电化腐蚀的反应速率大大加快。大家知道,[实验8—3]是转换反应、[实验8—4]和[实验8—5]是金属电化腐蚀的过程,也就是原电池原理。因此,金属电化腐蚀的事实也可这样论述:原电池的反应速率大大地快于置换反应。因为引入这个结论仅以实验为根据,还没有从理论上进行证明。因此,对这个结论,中师生只知其然,不知其所以然。有些学生以自己的水平作了如下的推理:原电池原理,是氧化—还原反应,即负极为氧化反应,正极为还原反应,它能把化学能转变为电能,并产生了电流,电流是电子作定向转移的现象,转换反应也是氧化—还原反应,也是电子转移的过程,即这二种化学反应都是电子转移的过程,而电子运动的速度应当是基本相同的,因此,电化腐蚀的反应速率应当和转换反应速率也基本相同。但是,实验却说明了他们的推理是错误的,因此,中师生就因不可理解而感到困惑。
为了消除中师生的这个困惑,为此,引入了“金属的双电层”理论,多年的教学实践证明了,它能成功地解开这个疑团。
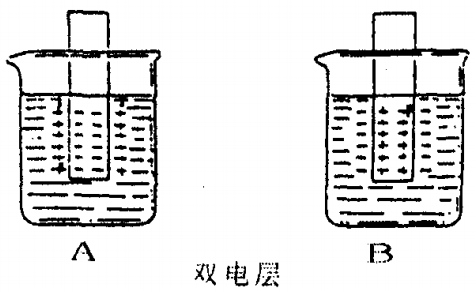
所谓的“金属双电层”理论,就是当金属片放入盐溶液中时,如果金属离子在金属晶体中所具有的能量比它在溶液中成为水合离子的能量高,那么金属离子就有成为水合离子而进入溶液的倾向。相反,如果金属离子在晶体中比它在水溶液中成为水合离子所具有的能量低,那么溶液中的金属离子有沉积到金属晶体上去的倾向。当金属离子由晶体进入溶液时,就使金属晶体有过多的电子而带负电荷。随着由晶体进入溶液的金属离子数的增加,金属上所带的负电荷数也就增加,由于静电作用,晶体上的离子进入溶液的速度逐渐减小。另一方面,盐溶液中的金属离子也可能再从溶液中沉积到晶体上去,盐溶液浓度越大,那么金属离子沉积到晶体上去的速度越大。最后,金属和它一定浓度的盐溶液必然会达到平衡,金属带一定量的负电荷,盐溶液则带同量的正电荷。金属越活泼,愈容易失去电子,它的离子进入溶液的倾向越大。进入溶液的金属离子受晶体负电荷的吸引,聚集到金属表面附近,成为一个正电荷层,跟晶体上的负电荷层形成所谓的双电层,在正负电层之间,也就是金属和盐溶液之间,产生了一定的电位差,如图A。相反的,如果把另一种金属放入盐溶液中时,溶液中的金属离子沉积到金属晶体上去,当达到平衡时,金属带正电荷,而溶液则由于过多的负离子而带负电荷,金属跟盐溶液之间也产生了相反的电位差,也形成了双电层,如图B。
现在将实验现象浅释如下。
[演示实验8—3]是锌和硫酸的置换反应,其速率快慢,决定于硫酸电离出的氢离子获得电子的速度快慢。因为,在稀硫酸溶液中,纯锌表面会形成A图的双电层,锌表面被阳离子层既正电荷层包围着。 溶液中氢离子,因受到正电荷层的排斥,不能轻易地从锌表面的负电荷层中获得电子。只有能量较大的氢离子,才可冲破正电荷层,进入双电层之间,并在负电荷层上获得了电子,变为氢原子。然后变为氢气,从锌表面放出。所以,置换反应,虽然是电子转移的过程,但是氢离子结合电子过程却受到正电荷层阻力。因此,置换反应的速率显然会慢些。
[演示实验8—4]和[演示实验8—5]是锌、铜和稀硫酸所组成的原电池。实际上,就是金属电化腐蚀过程。因为锌是较活泼的金属,容易失去电子。在溶液中其形成的是A图的双电层。在常温下, 它的电极电位![]() =-0.7628V,即为负极。而铜是不活泼金属,在溶液中,其形成的是B图的双电层。在常温下,它的电极电位
=-0.7628V,即为负极。而铜是不活泼金属,在溶液中,其形成的是B图的双电层。在常温下,它的电极电位![]() =+0.3402V,即为正极。因此,它们之间产生了电位差,也就是产生了电动势。当两极接通时,电子就从锌片上沿着导线流向铜片。使铜带上负电荷。这时,溶液中氢离子就可直接地从铜上获得电子,变为氢原子,氢原子相互结合又变为氢气,从铜片上放出。铜锌原电池因为能克服转换反应所产生的阻力,所以氢离子很容易从正极上获得电子,使反应的速率大大加快。由此可见,原电池反应速率快于置换反应的原因,也就是电化腐蚀的速率大大加快的原因。经过这样解释之后,中师生的困惑当然随之消失。
=+0.3402V,即为正极。因此,它们之间产生了电位差,也就是产生了电动势。当两极接通时,电子就从锌片上沿着导线流向铜片。使铜带上负电荷。这时,溶液中氢离子就可直接地从铜上获得电子,变为氢原子,氢原子相互结合又变为氢气,从铜片上放出。铜锌原电池因为能克服转换反应所产生的阻力,所以氢离子很容易从正极上获得电子,使反应的速率大大加快。由此可见,原电池反应速率快于置换反应的原因,也就是电化腐蚀的速率大大加快的原因。经过这样解释之后,中师生的困惑当然随之消失。
化学教学中,如果能深入教材,不断地探索教学的新思路,将有助于提高中师生的理解能力。它不仅能消除疑难点,而且能开拓他们的思维,扩大知识面。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
在高考化学电化学模块中,带离子交换膜的电化学装置是绝对高...
锌溴液流电池是一种大规模储能电池,相比传统铅酸电池锂离子...
【解析】: A.电解氧化的目的是在铝制品表面形成氧化膜,所以代...
并非所有放热反应都可以设计为原电池。能否设计为原电池的关...
空穴在半导体和绝缘体中扮演着重要角色,在化学中空穴缺电子...
一、天然冰晶石(NaAlF)的发现:18世纪的格陵兰矿物探索 天然...