
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、中和热概念及其数值
1、概念:
在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时释放的热量称为中和热
2、表示方法:
![]()
3、实质:
中和反应的实质是H+和OH-结合生成水,因而理解中和热时要注意以下几点:
(1)条件:稀溶液,因浓酸溶液或浓碱溶液稀释时会放出热量
(2)反应物:酸与碱 (在中学化学中,只讨论强酸和强碱反应的中和热)
(3)生成物及其物质的量:必须是形成1mol的H2O(l)
(4)表述:用文字叙述中和热时,不带“-”;用ΔH表示时,带上“-”,如:强酸与强碱反应的中和热为57.3 kJ·mol-1或ΔH=-57.3 kJ·mol-1
(5)强酸、强碱发生中和反应时,中和热为一定值,与酸、碱的用量无关,与其中一种过量也无关,但酸和碱放出的热量与其用量有关
(6)浓的强酸和强碱在发生中和反应的同时还要发生溶解,溶解要放出热量,故放出热量大于57.3kJ
(7)弱酸和弱碱在发生中和反应的同时还要发生电离,电离要吸收热量,故放出热量小于57.3kJ
(8)中和反应的实质是H+和OH-化合反应生成H2O。若反应过程中有其它物质生成(生成不溶物质或难电离的物质等),这部分热量不包含在中和热内。
二、中和反应反应热的测定
1、实验装置
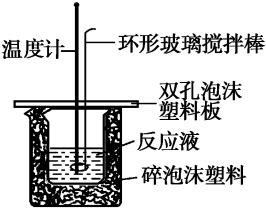
2、实验测量数据
(1)反应物温度的测量
①用量筒量取50 mL 0.50 mol·L-1盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用
②用另一个量筒量取50 mL 0.55 mol·L-1 NaOH溶液,用温度计测量并记录NaOH溶液的温度(数据填入下表)
(2)反应后体系温度测量
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度不变化,将最高温度记为反应后体系的温度(t2)
(3)重复上述步骤(1)至步骤(2)两次
3、数据处理
(1)取盐酸和NaOH溶液温度的平均值记为反应前体系的温度(t1)。计算温度差t2-t1)
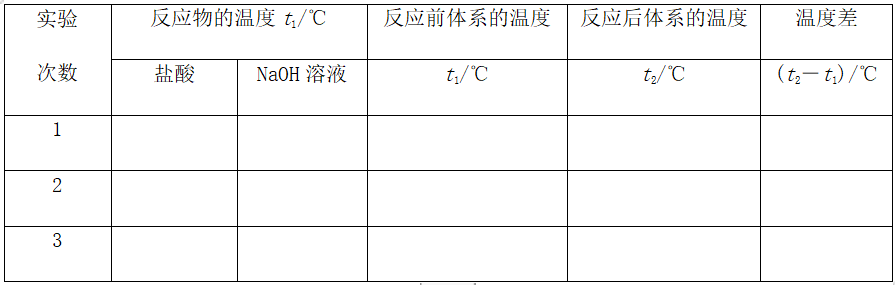
(2)取三次测量所得温度差的平均值作为计算依据
(3)根据温度差和比热容等计算反应热
4、中和热的计算
(1)计算依据:
Q=cmΔt ,式中:
Q为中和反应放出的热量,c为反应混合液的比热容
m为反应混合液的质量,Δt为反应前后溶液温度的差值
(2)计算技巧:
为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容
①50 mL 0.50 mol·L-1盐酸的质量m1=50 g,50 mL 0.55 mol·L-1 NaOH溶液的质量m2=50 g
②反应后生成的溶液的比热容c=4.18 J·(g·℃)-1,50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液发生中和反应时放出的热量为
Q=c·m·Δt=c·(m1+m2)·(t2-t1)=0.418(t2-t1) kJ
③生成1molH2O时放出的热量为
![]()
则中和热
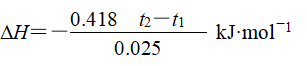
(3)中和热ΔH计算:
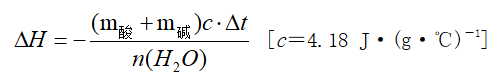
5、中和热测定实验中应注意的事项
(1)测量盐酸的温度后,要将温度计上的酸冲洗干净后,再测量NaOH溶液的温度,避免酸、碱在温度计的表面反应放热而影响测量结果
(2)实验中要用强酸、强碱的稀溶液(0.1~0.5 mol·L-1)
(3)测定中和热不能用弱酸或弱碱,因弱酸、弱碱电离时吸收热量而使测量数值偏低
(4)中和热的数值是57.3 kJ·mol-1,测定时与强酸、强碱的用量无关
(5)加过量碱液使酸完全反应,碱过量对中和热测定没有影响
(6)数据处理时,相差较大的数据可能是偶然误差引起的,应舍去
6、实验讨论
(1)装置中的环形玻璃搅拌棒能否用金属(不与酸、碱反应)质环形搅拌棒代替?为什么?
不能。原因是金属质环形搅拌棒易导热,造成实验过程中热量损失
(2)实验中所用HCl和NaOH的物质的量比为何不是1∶1而是NaOH过量?若用HCl过量行吗?
碱过量的目的是保证盐酸完全反应,若使盐酸过量,也可。
(3)能否用浓硫酸代替盐酸?对结果会产生什么影响?
不能。浓硫酸溶解于水时放热,所测ΔH偏小,即ΔH <-57.3 kJ·mol-1
(4)能否用醋酸代替盐酸或用氨水代替KOH溶液?对结果会产生什么影响?
不能。弱酸、弱碱电离吸热,所测ΔH 偏大,即ΔH >-57.3 kJ·mol-1
(5)温度计上的酸为何要用水冲洗干净?冲洗后的溶液能否倒入小烧杯?为什么?
因为该温度计还要用来测碱液的温度,若不冲洗,温度计上的酸会和碱发生中和反应而使热量散失,故要冲洗干净;冲洗后的溶液不能倒入小烧杯,若倒入,会使总溶液的质量增加,而导致实验结果误差
(6)酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入?
因为本实验的关键是测反应的反应热,若动作迟缓,将会使热量损失而使误差增大
(7)若改用100 mL 0.50 mol/L的盐酸和100 mL 0.55 mol/L的NaOH溶液,所测中和热的数值是否约为本实验结果的二倍(假定各步操作没有失误)?
否。因中和热是指酸与碱发生中和反应生成1 mol H2O时放出的热量,其数值与反应物的量的多少无关,故所测结果应基本和本次实验结果相同
(8)怎样用环形玻璃搅拌棒搅拌溶液,不能用铜丝搅拌棒代替的理由是什么?
环形玻璃搅拌棒应上下移动;铜传热快,热量损失大,因此不能用铜丝搅拌棒代替环形玻璃搅拌棒
7、误差分析
![]()
引起误差的实验操作 | 温度差 | |ΔH| |
保温措施不好 | 偏小 | 偏小 |
搅拌不充分 | 偏小 | 偏小 |
所用酸、碱浓度过大 | 偏大 | 偏大 |
用同浓度的氨水代替NaOH溶液 | 偏小 | 偏小 |
用同浓度的醋酸代替盐酸 | 偏小 | 偏小 |

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
物质溶于水时吸收或放出一定的热量,人们利用这些吸热或放热...
夏天到的时候,我们通常可以看到超市里有一种凉袋出售。在炎...
家住城郊或者农村的同学可能都注意到这样的现象:建筑工人将...
人教版化学必修二第二章第一节《化学反应与热能》,引入了中...
1.问题提出 在高中化学第一册第一章第三节放热反应的实验中...
在这里会讨论有关市面上有售的即热或即冻的敷包。这种敷包只...