
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
元素化合物
1.漂白粉可用于生活用水的消毒。
2.氢氧化铝可用于中和过多胃酸。
3.钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火。
4.钠与O2的反应产物与反应条件有关,即使钠在少量O2中燃烧也生成Na2O2。
5.常温下铁、铝遇浓HNO3、浓H2SO4发生钝化。钝化并不是不反应,而是属于化学变化,钝化体现了浓HNO3和浓H2SO4的强氧化性。
6.1 mol Na2O2固体中含离子总数为3NA。
7.1 mol Na2O2参与反应转移电子的物质的量不一定为1 mol。
8.钠与盐溶液反应,不能置换出盐的金属。
9.往盛有足量NH3的饱和NaCl溶液中通入足量的CO2,反应方程式是:NaCl(饱和)+NH3+CO2+H2O===NaHCO3↓+NH4Cl。
10.往BaCl2、CaCl2、Ba(NO3)2等溶液中通入CO2气体不发生反应,而往Ca(ClO)2、NaAlO2、Na2SiO3溶液中通入CO2发生反应。
11.往Ca(ClO)2、Ba(NO3)2溶液中通入SO2气体发生反应生成白色沉淀。
12.Al2O3、Al(OH)3既能与盐酸,又能与氢氧化钠溶液反应。
13.Al2O3、MgO可用作耐高温材料。
14.并不是铝与所有金属氧化物均能组成铝热剂。
15.铁与氯气反应只能生成FeCl3,氮气与氧气反应只能生成NO,硫在氧气中燃烧只生成二氧化硫,铁与足量稀HNO3反应只生成硝酸铁。
16.Fe与O2点燃Fe与H2O(g)(高温)反应的固体产物都是Fe3O4而不是Fe2O3。
17.铜在潮湿的空气中最终不是生成CuO,而是生成铜绿[Cu2(OH)2CO3]。
18.SiO2可用于制光导纤维,硅可制光电池。
19.酸性氧化物一般能与水反应生成相应的酸,但SiO2不溶于水;酸性氧化物一般不与酸作用,但SiO2能与氢氟酸反应。
20.SO2使含有酚酞的NaOH溶液褪色,表现SO2酸性氧化物的性质;使品红溶液褪色,表现SO2的漂白性;使溴水、酸性KMnO4溶液褪色,表现SO2的还原性;SO2与H2S反应,表现SO2的氧化性;SO2和Cl2等体积混合通入溶液中,漂白性不但不增强,反而消失。
21.把SO2气体通入BaCl2溶液中,没有沉淀生成,但若通入NH3或加入NaOH溶液,或把BaCl2改成Ba(NO3)2均有白色沉淀生成,前两者生成BaSO3沉淀,后者生成BaSO4沉淀。
22.浓硝酸和Cu(足量)、浓硫酸和Cu(足量)、浓盐酸和MnO2(足量)在反应时,随反应的进行,产物会发生变化或反应停止。
23.强氧化性酸(如HNO3、浓硫酸)与金属反应不生成H2;金属与浓硝酸反应一般生成NO2,而金属与稀硝酸反应一般生成NO。
24.实验室制备NH3,除了用Ca(OH)2和NH4Cl反应外,还可用浓氨水的分解(加NaOH固体或加CaO或加热)制取。而检验NH4+需用NaOH溶液并加热,用湿润的红色石蕊试纸检验生成的气体,以确定NH4+的存在。
25.Cu和一定量的浓硝酸反应,产生的是NO2和NO的混合气体,当Cu有剩余时,再加入稀硫酸,Cu可继续溶解。
基本理论、基本概念
1.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物。
2.酸性氧化物不一定是非金属氧化物,非金属氧化物也不一定是酸性氧化物。
3.含有离子键的化合物一定是离子化合物,共价化合物一定不含离子键。
4.同种元素组成的物质可能是纯净物,也可能是混合物。
5.重要的电子式
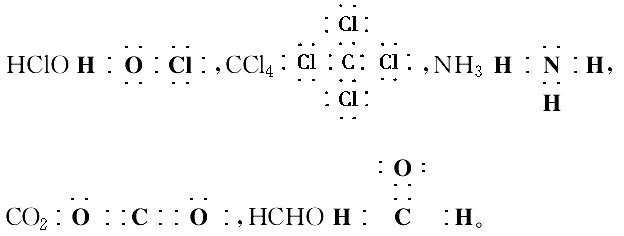
6.比例模型:如甲烷的比例模型:
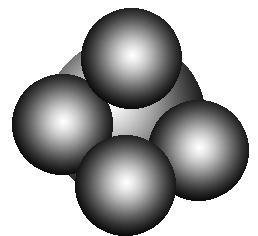
7.球棍模型:如甲烷的球棍模型:
8.Cl、Br、I的+1价含氧酸的结构式都可用“![]() ”表示。
”表示。
9.熔融状态下能导电的化合物是离子化合物,熔融状态下不能导电的化合物是共价化合物。
10.ClO-不论在酸性环境中还是在碱性环境中均能体现强氧化性,如ClO-与SO32-、I-、Fe2+均不能大量共存;ClO-能水解,因HClO酸性很弱,ClO-水解使溶液显碱性,如Fe3++3ClO-+3H2O===Fe(OH)3↓+3HClO,所以ClO-与Fe3+、Al3+均不能大量共存。
11.比较元素非金属性强弱时,应是该元素最高价氧化物对应水化物酸性的强弱,而不是非金属元素对应氢化物酸性的强弱。
12.化学键影响物质的化学性质,如稳定性等;分子间作用力和氢键影响物质的物理性质,如熔、沸点等。
13.常见吸热反应:所有盐的水解和电离过程、大多数的分解反应。
常见放热反应:燃烧、爆炸反应、金属与酸的置换、酸碱中和反应、2NO2 N2O4、大多数的化合反应是放热的。
N2O4、大多数的化合反应是放热的。
14.原电池放电时,电解质溶液中的离子是阳离子向正极移动,阴离子向负极移动。
15.原电池充电时,电解质溶液中的离子是阳离子向负极移动,阴离子向正极移动。
16.原电池放电时,盐桥中的离子是阳离子向正极移动、阴离子向负极移动。
17.电解池里电解质溶液中离子的移动方向为:阳离子向阴极移动,阴离子向阳极移动。
18.钢铁的析氢腐蚀或吸氧腐蚀的负极反应均为Fe-2e-===Fe2+。
19.金属腐蚀快慢与两极材料的活泼性有关,活泼性相差越大,金属腐蚀越快。
20.金属腐蚀快慢与接触介质有关,一般在非电解质溶液中的腐蚀较慢。
21.升高温度,不论吸热还是放热反应,也不论正反应速率还是逆反应速率都增大。
22.向恒温恒容已达平衡的反应体系中,充入“惰性气体”(不参加反应的气体),对平衡无影响。
23.增大压强(缩小体积),化学平衡向气体物质的量减小的方向移动,但V(正)、V(逆均增大)。
24.平衡常数K只受温度影响,既与任何一种反应物或生成物的浓度变化无关,也与压强的改变无关。
25.对于一个可逆反应,若升高温度,K值增大,则正反应为吸热反应。
26.盐水解规律:有弱才水解,越弱越水解,谁强显谁性,同强显中性,越热越水解,越稀越水解。
27.除去酸性溶液ZnCl2溶液中的FeCl2,应先通入Cl2或加入H2O2,再加入ZnO,使Fe3+水解生成沉淀过滤除去。
28.FeCl3、Fe2(SO4)3的水溶液蒸干所得固体不同:FeCl3溶液加热蒸干得Fe(OH)3,灼烧Fe(OH)3可得Fe2O3;Fe2(SO4)3溶液蒸干仍为Fe2(SO4)3。
29.弱酸酸式盐水溶液酸碱性,取决于酸式酸根离子电离程度和水解程度的相对大小。
30.碳酸钙与稀盐酸反应,实质是H+与沉淀溶解平衡中的CO32-反应,促进平衡向生成离子的方向移动。
31.盐溶液蒸干后并灼烧,有的能得到原溶质,有的不能得到原溶质而转化成其他物质,有的得不到任何物质。
化学实验
1.使用容量瓶、滴定管、分液漏斗第一步操作是“检漏”。
2.配制Fe2+、Sn2+等易水解、易被氧化的盐溶液,先把蒸馏水煮沸,再溶解,并加少量相应金属粉末和相应酸。
3.酸式滴定管不能装碱性溶液,碱式滴定管不能装酸性及氧化性溶液。
4.容量瓶不能长期存放溶液,更不能作为反应容器,也不可加热,瓶塞不可互用。
5.烧瓶、烧杯、锥形瓶不可直接加热。
6.能与盐酸反应产生有刺激性气味的无色气体,且产生的气体能使品红溶液褪色,加热又恢复原色的,只有SO32-和HSO3-。
7.点燃可燃性气体(如H2、CO、CH4、C2H4)或用CO、H2还原Fe2O3、CuO之前,要检验气体的纯度。
8.制取有毒气体(如Cl2、CO、SO2、H2S、NO2、NO)时,应在通风橱中进行,且进行尾气处理。
9.加热法制取并用排水法收集气体或吸收溶解度较大的气体(如NH3、HCl)时,要注意熄灯顺序或加装安全瓶。
有机化学
1.淀粉、纤维素、蛋白质都是天然高分子化合物,它们都是混合物。
2.能与Na2CO3或NaHCO3溶液反应放出CO2或使石蕊试液变红的有机物中必含有—COOH。
3.能发生消去反应的有机物为醇或卤代烃。遇浓硝酸变黄,可推知该物质是含有苯环结构的蛋白质。遇碘水变蓝,可推知该物质为淀粉。加入过量浓溴水,出现白色沉淀,可推知该物质为苯酚或其衍生物。
4.能发生水解反应的有机物为卤代烃、酯、二糖、多糖、蛋白质或含有肽键的物质。
5.检验卤代烃中的卤元素时,在水解后的溶液中先加稀HNO3再加AgNO3溶液。
6.检验蔗糖、淀粉等是否水解时,先在水解后溶液中加NaOH溶液中和,后加银氨溶液或Cu(OH)2悬浊液。
7、油脂不是高分子化合物。
8、聚丙烯中没有碳碳双键,不能使酸性高锰酸钾溶液褪色。
9、由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇;都是取代反应。
10、分子式为C6H12,主链碳原子数为4个的烯烃共有4种,不要忘记2-乙基-1-丁烯以及3,3-二甲基-1-丁烯。
11、与氢氧化钠和二氧化碳反应,苯甲酸→苯甲酸钠,苯酚→苯酚钠→苯酚,苯酚与苯甲酸钠溶液分层,可以分液法分离。
12、维勒第一个以无机物为原料合成有机物尿素,凯库勒最早提出苯的环状结构理论。
13、取少量卤代烃与氢氧化钠溶液加热煮沸片刻,冷却后先加入稀硝酸酸化后,再加入硝酸银溶液,生成黄色沉淀,可知卤代烃中含有碘元素。
14、只用碳酸氢钠溶液能鉴别乙酸、乙醇、苯和四氯化碳四种液态物质,乙酸与碳酸氢钠反应产生气泡,乙醇溶解,苯的密度小于水,四氯化碳的密度大于水。
15、从戊烷的三种同分异构体出发,戊基有8种,丁基有四种,戊烯有五种。
16、检验淀粉水解产物,可在水解所得溶液中加入先加入氢氧化钠溶液中和,再加新制的银氨溶液后水浴加热。
17、符合要求的扁桃酸C6H5CH(OH)COOH同分异构体,从苯环的取代类别分析,一类是含有HCOO-、HO-和-CH3的三取代苯,共有10个异构体;另一类是含有-OH和HCOOCH2-的二取代苯,有三种。一共有13种
18、少量SO2通入苯酚钠溶液中的离子反应:2C6H5O-+SO2+H2O=2C6H5OH+SO32-
19、酒精溶液中的氢原子来自于酒精和水。
20、一分子β-月桂烯与两分子溴发生加成反应的产物(只考虑位置异构)理论最多有4种,容易遗忘掉1,4-加成产物。
21、CH2=CHCH3的名称是丙烯,CH3CH2CH2OH叫做1-丙醇,CH3CH2CH(CH3)OH叫做2—丁醇,CH3CHClCH3叫做2-氯丙烷
22、(CH3)2CClCOOH+2NaOH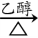 CH2=C(CH3)COONa+NaCl+2H2O
CH2=C(CH3)COONa+NaCl+2H2O
23、由乙烯制备乙酸,既可以通过乙烯→乙醇→乙醛→乙酸的路线,也可以通过乙烯→乙醛→乙酸,或由乙烯直接氧化成乙酸。工业上具体采用哪一条路线,取决于原料、设备、环保、投资、成本等因素。
24、日常生活中使用的电器开关外壳、灯头等都是用电木塑料制成的。电木塑料的主要成分是酚醛树脂,由苯酚和甲醛在一定条件下通过缩聚反应得到。
25、了解减压分馏的原理和在什么情况下使用。
26、乙醇、乙二醇和丙三醇(俗称甘油)都属于饱和醇类,官能团种类相同、个数不等,分子组成上不是相差若干个CH2,它们不是同系物。
27、当氨基酸在水溶液中主要以两性离子形态存在时,溶解度最小,可结晶析出晶体。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、选择题中的“坑” (细节决定成败) ①过量还是少量; ②化合物还是单质或混合物...
但凡要写字,就会写错别字,化学学科也不例外。化学试卷上有哪些让老师原地吐血的错别...
...
1)所有的置换反应都是氧化还原反应,所以的复分解反应都不是氧化还原反应,有单质参加...
...
高考是一个必须面对的课题,最好的方式就是用平常心去对待。静下心来,科学、合理地安...