
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
电解饱和食盐水制取Cl2、H2、NaOH,是氯碱工业的基础化学原理,在国民经济中占有十分重要的地位,可谓“一个化学反应养活成千上万的人口”,所以该工艺过程被列入中学化学课程.现就学生学习中常常遇到的一些问题讨论如下.
问题1、食盐水中有Cl-、OH-两种阴离子,电解过程OH-也会与Cl-一样移向阳极区,按理应该使阳极区碱性增强,可是给含酚酞的饱和食盐水通电时,为什么阴极区溶液变红而阳极区溶液却始终不变红呢?
电解食盐水,阴极区溶液变红很容易解释:在阴极,H+不断得电子被还原:2H++2e-=H2↑,H+浓度下降,H2O的电离平衡被破坏,导致OH-浓度上升,溶液碱性增强。
我们要意识到,以上只是对已有事实的“合理解释”,阴极区溶液碱性增强,并非逻辑推理的结果。试想,如果溶液中H+的迁移速率出奇地快,通电的瞬间溶液中所有游离的H+便集中到阴极区,其运动速率远远超过了水电离的速率(即OH-浓度增大的速率),情况将会如何呢?(阴极区溶液应呈酸性,而非碱性。)
所以电解初期,阴极区溶液变红的原因,严格说应该是由于H+的放电速率快于溶液中H+迁移的速率。同理,电解初期,阳极区溶液没有变红也是因为OH-迁移速率过慢,不如Cl-放电的速率快,2Cl--2e-=Cl2,产生的Cl2随即与水作用:Cl2+H2O=H++Cl-+HClO,产生了酸导致阳极区溶液酸性增强。
虽然电解过程中一直有OH-向阳极区移动,但阳极区源源不断产生的H+足以将移动过来的OH-中和掉,所以自始至终阳极区的酚酞溶液都不会变红。另外还有一个原因,那就是随着阳极区氧化性物质(溶解的Cl2、产生的HClO等)的积累,酚酞本身也会被氧化破坏。
问题2、电解食盐水过程中,OH-有没有可能在阳极上放电产生少量O2?
答案是肯定的.氯碱工业的阳极气体产物中,是允许含有一定比例的O2的。
其实,单从电极电势看,![]() (O2/OH-)=0.40V,
(O2/OH-)=0.40V,![]() (Cl2/Cl-)=1.36V,前者是低于后者的,也就是说理论上OH-比Cl-更容易在阳极失去电子。
(Cl2/Cl-)=1.36V,前者是低于后者的,也就是说理论上OH-比Cl-更容易在阳极失去电子。
那么实际上为什么阳极以得到Cl2为主呢?原因有两点:一方面目前采用的电解条件下,O2与Cl2相比,在电极表面不易形成气泡析出(所谓“过电位”较高);另一方面,在饱和食盐水中Cl-浓度大,放电的机会相对较多(Cl-浓度增大,依据能斯特方程,φ(Cl2/Cl-)有所降低,Cl-的还原性相对增强)。这也是我们一直强调“电解饱和食盐水”,而非电解任意浓度的食盐水的原因之一。
采用较低的电压,电解较小浓度的食盐水时,完全有可能出现阳极Cl-根本不放电的情况,大家可参考2014年北京高考理综试卷第28题文献资料。实际上,在多种离子共存的体系里,电解的微观过程非常复杂,即使OH-放电,产物也未必一定是O2,还可能得到H2O2(酸性条件)、HO2-(碱性条件)、—OH(羟基自由基)、O(游离氧原子)、O3等各种不同形态的产物。
问题3、为什么离子交换膜法电解食盐水,阴极区通入的水里要含有少量NaOH?
主要是为增强其导电性.试想,如果开始阴极区只用纯水,则整个电解池的电阻很大,这样会降低电解速度,影响生产效率。
问题4、电解食盐水的电解槽内,阳离子膜是如何保证只让阳离子通过的?
这类特殊的离子选择性透过膜是现代材料化学的杰作,膜上布满微孔(肉眼不可见),而膜的表面则是“挂”满了带有特定电荷的离子。图1就是一种阳离子膜(只允许阳离子透过)的结构示意图。
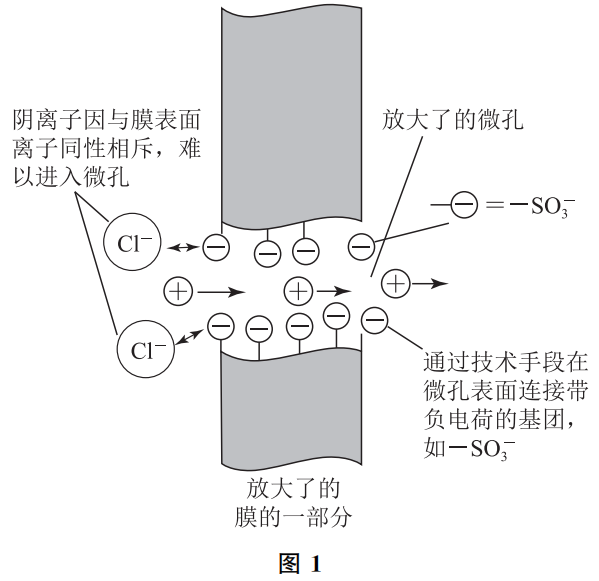
由于膜的表面布满了带负电荷的阴离子—磺酸基阴离子(—SO3-),当溶液中带同性电荷的阴离子靠近时会受到排斥,所以阴离子是不可能靠近并透过膜上微孔的。而阳离子则不然,可以在孔内阴离子的诱导下沿着电场规定方向顺利透过微孔,到达膜的另一侧。
如果将带负电荷的—SO3-换成带有正电荷的—NH3+(氨基阳离子),该膜即变为只允许阴离子透过的阴离子选择性透过膜了。
问题5、电解食盐水时,为什么阳极反应式(2Cl--2e-=Cl2↑)与阴极反应式(2H++2e-=H2↑)直接相加不能得到总反应式(2Cl-+2H2O Cl2↑+H2↑+2OH-)?
Cl2↑+H2↑+2OH-)?
这是教科书里对阴极反应式书写的差异导致的。
从微观上看,在阴极上得电子的确实是带正电荷的H+,于是教科书就直接把阴极的反应方程式写作2H++2e-=H2↑。但我们仔细考证H+的来源可知,它不是本来就大量存在于溶液中的,而是随着电解的进行由H2O分子不断电离出来的,根据离子方程式书写规则,弱电解质H2O应保留分子形式,故严格说来,阴极的电极反应式应写作
2H2O+2e-=H2↑+2OH-。
以此方程式与阳极电极方程式2Cl--2e-=Cl2↑相加,即可得到正确的总反应方程式。
同样道理,用惰性电极电解硫酸铜溶液时,其阳极的电极方程式也不宜简单写成4OH--4e-=2H2O+O2↑,而应该写作2H2O-4e-=4H++O2↑。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
锌溴液流电池是一种大规模储能电池,相比传统铅酸电池锂离子...
【解析】: A.电解氧化的目的是在铝制品表面形成氧化膜,所以代...
并非所有放热反应都可以设计为原电池。能否设计为原电池的关...
空穴在半导体和绝缘体中扮演着重要角色,在化学中空穴缺电子...
一、天然冰晶石(NaAlF)的发现:18世纪的格陵兰矿物探索 天然...
【导读】“正/负”看电势,按照电势高低,高正低负,绝不互换...