
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
电极方程式实际上是氧化还原反应的拆分,格式为“还原剂-电子+……→氧化产物+……”或“氧化剂+电子+……→还原产物+……”。在思考电极反应时,一定要多关注的是物质的性质、元素价态的变化以及产物形态的书写。
一、水溶液中燃料电池的电极方程式书写
提示:O2-在水溶液中不存在,酸性溶液中会和2个H+生成1个H2O,中性或碱性溶液中会和1个H2O生成2个OH-。
这也是离子反应的一个难点——附加粒子的写法。它是指根据反应原理将主要离子写上之后,还需要根据溶液的环境写一些其它离子或分子才能将离子反应写完整。比如在酸性溶液中写H+和H2O;在碱性溶液中写OH-和H2O;在中性溶液中反应物写H2O,生成物写H+或OH-。
以CH4燃料电池为例(很难,仔细琢磨)
1、在酸性溶液中的电极反应
负极为:CH4-8e-+2H2O=CO2+8H+
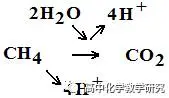
CH4是还原剂,反应后变为氧化产物CO2。增加的2个O(-2)需要由酸性溶液中的2个H2O提供。
CH4和2个H2O中共8个H(+1)在酸性溶液中释放为8个H+。此过程中,H2O和H+是附加粒子。
正极为:2O2+8e-+8H+=4H2O
O2得到4e-后变为2个O2-释放到水中,O2-在水中不存在,会和酸性溶液中的4个H+结合生成2个H2O。
2、在碱性溶液中的电极反应
负极为:CH4-8e-+10OH-=CO32-+7H2O
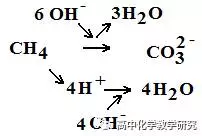
CH4是还原剂,反应后生成CO2,在碱性溶液中继续被反应为CO32-(碱性溶液中CO2会和OH-继续反应生成CO32-)。增加的3个O(-2)需要由碱性溶液中的6个OH-生成3个H2O提供。(碱性溶液中要用2个OH-生成1个H2O提供1个O(-2),思考一下为什么不能用3个H2O提供)
CH4同时会释放出4个H+,会与4个OH-中和生成4个H2O。总计消耗10个OH-,生成7个H2O。此过程中,OH-和H2O是附加粒子。
正极为:2O2+8e-+4H2O=8OH-
O2得到4e-后变为2个O2-释放到水中,O2-在水中不存在,会和碱性溶液中的2个H2O结合生成4个OH-。
二、解决各种其它电池的电极方程式书写的简单办法
1、通用解决方法
大多数原电池的电极反应,都要利用内电路(电解质体系)中某个离子做传导离子,这个离子一般由一个电极产生,另一个电极消耗。而已经知道的是阳离子向正极移动,阴离子向负极移动。可以推理出
若传导离子为X-,
则负极的电极反应为:还原剂-ne-+X-+……=氧化产物+……
正极的电极反应为:氧化剂+ne-+……=氧化产物+ X-+……
若传导离子为M+,
则负极的电极反应为:还原剂-ne-+……=氧化产物+ M++……
正极的电极反应为:氧化剂+ne-+M++……=氧化产物+……
2、一些示例:
看一下上面的CH4燃料电池在酸性溶液(传导离子为H+)中和在碱性溶液(传导离子为OH-)中的电极反应是不是如此。
(1)锂电池的总反应为Li+CoO2=LiCoO2,电解质为熔融Li2CO3,传导离子为Li+,则它的两个电极反应为:
负极:Li- e-=Li+
正极:CoO2+e-+ L i+= L iCoO2
(2)燃料电池总反应为2CO+O2=2CO2,一个电极通入CO,另一个电极通入O2和CO2,电解质为熔融Na2CO3,传导离子为CO32-,则它的两个电极反应为
负极:2CO-4e-+2CO32-=4CO2,
正极:O2+4e-+2CO2=2CO32-。
(3)碱性银锌电池总反应为Zn+Ag2O+H2O=Zn(OH)2+2Ag。电解质为强碱水溶液,传导离子为OH-,则它的两个电极反应为
负极:Zn-2e-+2OH-=Zn(OH)2,
正极:Ag2O+2e-+H2O=2Ag+2OH-。
三、一些复杂的电解池的电极方程式书写也可以用这种方法。
【2015福建卷】某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。
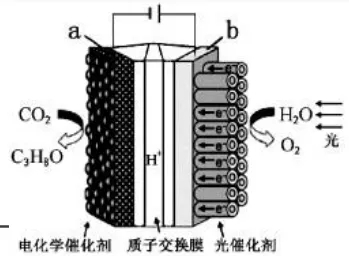
在本题中,传导离子为H+。根据电解池中“阳离子向阴极移动”,则两电极方程式书写可能为:
阴极:……+H++e-=……
阳极:……-e-=……+H+
本题的两个电极方程式为:
阴极(a极):3CO2+18H++18e-=C3H8O+5H2O
阳极(b极):2H2O-4e-=O2+4H+
【练习】
1、已知Ge+2NaOH+H2O=Na2GeO3+2H2↑,若用Ge、Pt做电极,NaOH做溶液,写出负极的电极反应是。正极的电极反应是。
2、写出C2H5OH燃料电池在不同溶液中的电极反应:
(1)酸性溶液中,负极 。正极 。
(2)碱性溶液中,负极 。正极 。
3、[2019全国3、有修改]为提升电池循环效率和稳定性,科学家利用三维多孔海绵状Zn可以高效沉积ZnO的特点,设计了采用强碱性电解质的Zn—NiOOH二次电池,结构如下图所示。电池反应为ZnO(s)+2Ni(OH)2(s) Zn(s)+2NiOOH(s)+H2O(l)。
Zn(s)+2NiOOH(s)+H2O(l)。
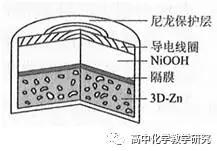
写出放电时的电极反应:负极 。正极 。
写出充电时的电极反应:阳极 。阴极 。
【练习答案】
1、Ge-4e-+6OH-=GeO32-+3H2O,4H2O+4e-=2H2↑+4OH-。
2、(1)C2H5OH-12e-+3H2O=2CO2+12H+
3O2+12e-+12H+=6H2O
(2)C2H5OH-12e-+16OH-=2CO32-+11H2O
3O2+12e-+6H2O=12OH-
3、负极:Zn-2e-+2OH-=ZnO+H2O。
正极:2NiOOH+2e-+2H2O=2Ni(OH)2+2OH-。
阳极:2Ni(OH)2+2OH--2e-=2NiOOH+2H2O。
阴极:ZnO+2e-+H2O=Zn+2OH-。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一、数列的表达式问题 例:(2019高考全国卷Ⅲ)直链的多磷酸盐是...
晶体中某原子或离子的配位数:是指离中心原子或离子最近的原...
在“难点四:突破电子式书写的困惑”中,已经详细介绍了利用...
1 、熟悉常见的有机合成路线 RCH=CH 2 → RCH 2 CH 2 X → RCH 2 CH 2 O...
现在很多简单的实验考查,常常不再考查明显的实验错误,而是...
一、对于高一的初学者,CO 2 通入NaOH溶液反应的过量问题,为什...