
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
基础篇
1、现代元素周期表是按照相对原子质量的大小编排的吗?
不是。门捷列夫发表的元素周期表是按照相对原子质量排序的,这也成为困扰了他一生的题—他的元素周期表出现了个别元素“相对原子质量颠倒”的现象。现代元素周期表排序已经更正为原子序数(在数值上等于核电荷数)。
2、元素周期表中的族序数等于最外层电子数吗?
不对。只有主族元素的族序数等于最外层电子数,例如氯元素最外层电子数为7,其在周期表中位于第Ⅶa族。而副族和第Ⅷ族元素不存在这一数量关系,副族和第Ⅷ族元素最外层电子数多为1或2。
3、最外层电子数为2一定为主族元素吗?
不一定。最外层电子数为2可以是主族元素(第ⅡA族),也可以是副族和第Ⅷ族元素(相关知识我们将在选修3讲到),还可以是0族元素(He)。只有某元素原子的最外层电子数存在如下关系:3≤最外层电子数<8,我们才可以确认其是主族元素。
4、同周期相邻主族元素的原子序数之差一定是1吗?
不一定!同周期相邻主族元素的原子序数之差一般为1,但是同周期第Ⅱa族和第Ⅲa族元素原子序数的差值取决于它们所在的周期数,具体如下:
周期数 | 第二或第三周期 | 第四或第五周期 | 第六或第七周期 |
差值 | 1 | 11 | 25 |
5、不查元素周期表能否知道某一主族元素的原子序数?
可以,前提是你需要知道它在周期表中的位置。当然,前36号元素是我们要求熟记的。其它的我们只需要掌握以下规律即可:
①位于过渡元素左侧的主族元素,即ⅠA族、ⅡA族,同主族、相邻周期元素原子序数之差为上一周期元素的种数。例如我们想知道铷的原子序数可以通过钾的原子序数来计算:钾的原子序数为19,它所在的周期为第四周期,共有18种元素,则铷的原子序数为19+18=37,以此类推可以计算铯的原子序数为55。
②位于过渡元素右侧的主族元素,即ⅢA族~ⅦA族,同主族、相邻周期元素原子序数之差为下一周期元素的种数。例如我们想知道溴的原子序数可以通过氯的原子序数来计算:氯的原子序数为17,而溴所在的周期为第四周期,共有18种元素,则溴的原子序数为17+18=35,以此类推可以计算碘的原子序数为53。
6、能否根据某一元素的原子序数推知它在周期表中的位置?
可以,我们可以利用稀有气体的原子序数(2,10,18,36,54,86,118)来推断,一般有以下情况:
(1)比大小定周期
比较该元素的原子序数与0族元素的原子序数大小,找出与其相邻近的0族元素,那么该元素就和序数大的0族元素处于同一周期。
(2)求差值定族数
①若某元素原子序数比相应的0族元素多1或2,则该元素应处在该0族元素所在周期的下一个周期的 Ⅰa 族或 Ⅱa 族;
②若比相应的0族元素少5~1时,则应处在同周期的ⅢA~ⅦA族;
③若差其他数,则由相应差数找出相应的族。
例如我们想知道115号元素在周期表中的位置,可以把它与0族118号元素相比较,发现它比118号原子序数少3,应在第ⅤA族。
7、从锂→铯,碱金属单质的密度是逐渐增大的吗?
不是。认真观察课本P7所给的表格数据我们会发现,准确的说从锂→铯,碱金属单质的密度是呈增大趋势,其中从钠到钾的密度变化出现反常。这是因为从钠到钾原子半径增大的程度超过了原子质量增大的程度。
8、在实验室金属锂、钠和钾都可以保存在煤油里吗?
金属锂不可以。锂是最轻的金属,密度比煤油的密度小,会浮在煤油液面上被空气中的氧气氧化,因此在实验室锂一般存放于固体石蜡中。而钠和钾通常保存在煤油中。
9、钾的金属性比钠强,钾能否从NaCl溶液中置换出钠?
不能。因为钾先与NaCl溶液中的水发生反应而不能置换出NaCl中的钠,类似于我们上学期在课堂中演示的钠与硫酸铜溶液反应,我们最终并没有看到红色的铜单质,而是看到蓝色絮状沉淀。
10、查课本P8,氯气的密度数值为3.214,而溴单质的密度数值为3.119,所以从氟气→碘单质,卤素单质的密度也是呈增大趋势吗?
不是。请仔细查看单位
11、由于非金属性F>Cl>Br>I,所以在水溶液中的酸性就有HF>HCl>HBr>HI吗?
错误。元素的非金属性强弱比较我们目前主要有以下依据:
①根据单质与氢气化合生成氢化物的难易程度及氢化物的稳定性;
②根据最高价氧化物对应的水化物的酸性强弱;
③根据水溶液中非金属之间的置换反应。
酸性比较应该是:HClO4>HBrO4>HIO4(氟没有最高正价),氢化物的稳定性才是:HF>HCl>HBr>HI,事实上HF、HCl、HBr、HI在水溶液中的酸性是逐渐增强的,其中氢氟酸是弱酸,其余是强酸。
12、氯气能从NaBr溶液中置换出Br2,F2比Cl2活泼,F2能否从NaBr溶液中置换出Br2?
不能。因为F2太活泼,会与NaBr溶液中的水反应生成HF和O2(2F2+2H2O=4HF+O2),不能从NaBr溶液中置换出Br2。
13、质量数相同的原子一定属于同种元素吗?
不一定。质子数相同的原子属于同一种元素,而质量数相同的原子不一定属于同种元素。如:146C和147N
14、18O2与16O2互为同位素吗?
不是。同位素指的是同一元素的不同原子,这两种微粒属于分子,是同一种物质。
15、同位素中的不同核素构成的单质性质上完全相同吗?
不一定,看情况。如果同位素中的不同核素构成分子结构相同的单质,则化学性质没有差别,物理性质有差别。如果不同核素构成分子结构不同的单质,则化学性质和物理性质都有差别。
如氢的同位素有氕(H)、氘(D)、氚(T),形成相同结构的双原子分子时,存在6种分子H2、D2、T2、HD、HT、DT,它们的化学性质相同,但物理性质如质量、密度、熔沸点等都有差别。
如果分别用16O和18O来形不同分子结构的单质16O2和18O3,则其化学性质和物理性质都不相同。
拓展篇
1、在碱金属的密度变化中,为什么会出现K的密度比Na小的“反常”现象?
在碱金属中,随着原子序数的增加,碱金属的密度一般是增大的。这是由于这几种碱金属的晶体结构方式相同,随着原子序数的增加,原子量增加所起的作用超过了原子半径(或原子体积)增大的作用(见下表)。
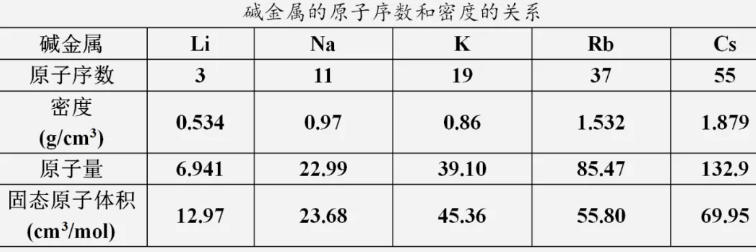
但其中有一例“反常”现象,即钾的密度比钠的密度小。这是因为从钠到钾原子量的増大所起的作用小于原子体积增大所起的作用。从表中数据可以计算相邻两种元素的原子量增加的倍数依次为3.31、1.70、2.19、1.55,而原子体积增大倍数依次1.83、1.92、1.23、1.25。显然,从钠到钾原子量增大的倍数小于原子体积增大的倍数,因此钾的密度小于钠,出现“反常”。
2、碱金属在燃烧时,为什么有的形成氧化物,有的形成过氧化物或超氧化物?
碱金属在空气中燃烧时,锂与氧化合生成氧化锂Li2O,钠与氧化合生成过氧化钠Na2O2,钾、铷、铯与氧化合则生成超氧化物,分别是KO2、RbO2、CsO2。同是碱金属,却生成不同的氧化物,原因是各种碱金属形成氧化物的稳定性不同。
碱金属的氧化物、过氧化物和超氧化物都是离子化合物,它们的稳定性取决于离子晶格是否稳定,而晶格的稳定性又主要由金属离子半径的大小决定。在离子晶体中,只有当正负离子的半径相差不大时(即半径比在一定范围内),正负离子才能完全接触,晶体才稳定。若正负离子的半径相差大,它们不能紧密接触,形成的晶体就不稳定。碱金属的阳离子Li+、Na+、K+、Rb+、Cs+半径逐渐增大,分别为(单位是10-10m):0.68、0.97、1.33、1.47、1.67。而在阴离子O22-、O2-和O2-中以O2-的半径最小(1.32)。所以在碱金属中,只有半径较大的离子K+、Rb+、Cs+易形成稳定的超氧化物,Na+的半径较小,倾向于形成过氧化物,Li+最小,生成正常的氧化物。
3、常温下为什么氟、氯单质为气体,溴单质为液体,碘单质为固体?它们的熔、沸点有什么变化规律?
卤素单质的分子F2、Cl2、Br2、I2都是双原子的非极性分子,分子之间存在着色散力。色散力的大小与分子的变形性有关。随着原子序数的增加,卤素单质的相对分子质量增大,电子数增多,因而分子的变形性增大,分子之间的色散力增强。F2分子和Cl2分子的色散力较小,因而分子间的距离大,常温下呈气态。溴(Br2)分子间的色散力较大,分子之间距离较小故常温是液态。碘(I2)分子间的色散力最大,分子间距离最小,因而常温下分子的聚集态为固态。
要使分子晶体熔化或气化就需破坏分子间的作用力,使质点的运动速度加快。因为色散力是一种较弱的分子间作用力,所需的能量比较小,所以卤素单质的熔、沸点都较低。随着原子序数的增加,分子间的色散力增强。要想克服分子间的作用力,使晶体熔化或气化所需的能量就逐渐增大。所以,卤素单质的熔、沸点是随着原子序数的增加而升高的。
4、卤素单质氟、氯、溴、碘的颜色为什么依次加深?
物质所呈现的颜色,通常是由于物质对不同波长的光有选择性吸收而产生的。物质呈现透过光的颜色(即与吸收光互补的颜色)。物质吸收哪种波长的光,与物质分子中的电子所占据的最高轨道和最低的空轨道间的能级差有关。这个能级差与原子序数及原子半径有关。
如何解释卤素的颜色(F2为浅黄绿色、Cl2为黄绿色、Br2为深红棕色、I2为紫黑色)依次加深呢?因为随着原子序数的増大,从F2到I2分子中的价电子激发所需的能量(轨道的能级差)减小。氟吸收能量大而波长短的可见光—紫色,而透过波长长能量小的浅色光—浅黄绿色。碘吸收波长长能量小的光,而碘呈现透过波长短的那部分光的颜色—紫色。由于从F2到I2随着原子序数的增大,卤素单质分子中的电子激发所需的能量减小,故所吸收光的能量减小波长增大,而所呈现透过光的波长向短波方向移动,故颜色由可见光的浅色逐渐加深到紫色。
5、为什么碘能发生升华现象?
升华不是少数物质的特殊现象, 所有加热时稳定的固态物质,在三相点以下的任何温度,当压力降到小于其平衡蒸气压时,固体就会升华。换言之,熔点高且三相点的蒸气压越大的物质就越易升华。碘具有熔点高(113. 6℃)、三相点的蒸气压大(89. 8毫米汞柱) 两个条件,所以在敞口容器里加热碘的固体时,由于碘蒸气不断逸出,始终达不到三相点的压力,碘就不经熔化而直接升华。由此可知,做碘的升华实验,应使其温度低于113. 6℃。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【导读】键长和键能的关系在化学中通常表现为反比规律:键长越短,键能越大,但受原子...
...
元素周期律的应用,总会遇到金属性和非金属性强弱判断和比较。 苏教版《化学必修第一...
一、研究历史 自然界中物质常见的存在形式有气态、液态和固态,决定物质状态的主要原...
人教版高中化学必修第一册2019年6月第1版2024年7月第8次印刷P 10 3 讲解卤素单质与氢...
冰在0℃开始融化。这是本家都熟悉的事儿。 然而,世界上竟有热冰它在3.8℃方才融化! ...