
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化工流程中提纯各种金属离子(混有杂质Fe3+)的除杂过程,常常加入相应价态的金属氧化物、氢氧化物、碳酸盐、碱式碳酸盐等为除杂试剂,可以使得Fe3+离子转化为Fe(OH)3沉淀而除去。其中涉及什么样的反应原理?为什么?
案例1.现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),将其制成溶液I,然后按图示步骤进行提纯:
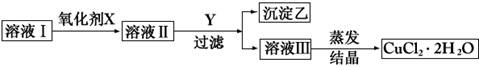
请回答下列问题:
(1)本实验最适合的氧化剂X是________。
(2)物质Y可能是________
(3)本实验用加碱沉淀法能不能达到目的?_____,原因是_____________。
(4)除去Fe3+的有关离子方程式是______________。
解答:(1)最适合的氧化剂X为绿色氧化剂:H2O2。
(2)物质Y可能是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等。
(3)不能,因为加NaOH等碱溶液也会将Cu2+离子转化为Cu(OH)2。
(4)Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
2H++CuO== Cu2++H2O
或2H++Cu(OH)2==Cu2++2H2O
或2H++CuCO3== Cu2++CO2↑+H2O
或4H++Cu2(OH)2CO3==2Cu2++CO2↑+3H2O
(4)问用总反应式表示:3CuO+2Fe3++3H2O==2Fe(OH)3+3Cu2+
或3Cu(OH)2+2Fe3+==2Fe(OH)3+3Cu2+
或3CuCO3+2Fe3++3H2O==2Fe(OH)3+3CO2↑+3Cu2+
或3Cu2(OH)2CO3+4Fe3++3H2O==4Fe(OH)3+3CO2↑+6Cu2+
本质原因:(4)问可借助于水解平衡理解所涉及的反应过程。由于Fe3+离子水解呈酸性,可向溶液中加入CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等试剂与H+反应导致H+减少,水解平衡右移,溶液pH增大,调节溶液pH的目的是促进Fe3+水解转变为Fe(OH)3沉淀而分离除去。
案例2.为了除去氯化镁晶体中的杂质Fe3+,先将其溶于水,加入足量的氢氧化镁,充分反应,过滤结晶。写出除去Fe3+所发生的总反应的离子方程式。
解答:3Mg(OH)2(s)+2Fe3+(aq)==2Fe(OH)3(s)+3Mg2+(aq)
本质原因:可借助于沉淀溶解平衡理解反应结果。由于Fe(OH)3的溶度积(4.0×10-38)远小于Mg(OH)2的溶度积(5.6×10-12),实际上是沉淀溶解平衡的移动,即Mg(OH)2溶解产生的OH-与Fe3+结合生成更难溶的Fe(OH)3沉淀,实现了沉淀转化从而除去杂质Fe3+。
案例3.用软锰矿(主要成分MnO2)浊液吸收空气中的SO2,得到的硫酸锰溶液中含有Fe3+、Cu2+杂质,常温下向溶液中加入MnCO3调节pH=4,过滤;在加入Mns,过滤,得到硫酸锰溶液。为什么加入MnCO3调节溶液pH=4时,Fe3+已除尽?为什么用Mn(OH)2、Mn2(OH)2CO3等都可以替代MnCO3?为什么加入MnS可除尽Cu2+?请用离子方程式表示并通过溶度积计算说明原因。已知常温下,Fe(OH)3、Cu(OH)2、CuS、MnS、MnCO3的溶度积分别为:4.0×10-38、2.2×10-20、1.3×10-36、4.6×10-14、2.2×10-11。
解答:
3MnCO3+2Fe3++3H2O==2Fe(OH)3+3CO2↑+3Mn2+
3Mn(OH)2+2Fe3+==2Fe(OH)3+3Mn2+
3Mn2(OH)2CO3+4Fe3++3H2O==4Fe(OH)3+3CO2↑+6Mn2+
Mns+Cu2+==CuS+Mn2+
定量说明:向溶液中加入MnCO3或Mn(OH)2或Mn2(OH)2CO3调节pH=4,说明溶液c(OH-)=1.0×10-10mol·L-1,Ksp[Fe(OH)3]=4.0×10-38==c(Fe3+)×c3(OH-),求c(Fe3+)=4.0×10-8mol·L-1,即此时沉淀后溶液c(Fe3+)﹤1.0×10-5mol·L-1,可认为溶液中的Fe3+离子已完全沉淀或已有效除去。
Ksp[Cu(OH)2]=2.2×10-20==c(Cu2+)×c2(OH-),c(Cu2+)= 2.2mol·L-1,Cu2+离子浓度远大于1.0×10-5mol·L-1,说明此时溶液中的Cu2+离子未除去。
将反应MnS+Cu2+==CuS+Mn2+设置为沉淀溶解平衡,则有平衡常数表达式K==c(Mn2+)÷c(Cu2+)=[c(Mn2+)×c(S2-)]÷[c(Cu2+)×c(S2-)]=Ksp(Mns)÷Ksp(CuS)=(4.6×10-14)÷(1.3×10-36)=3.5×1022,该反应的平衡常数K远大于105,可认为反应进行完全,说明溶液中的Cu2+离子已有效除去。
类比:除去Zn2+中混有的Fe3+、除去Ni2+中混有的Fe3+,应选择何种试剂?就自然会理解。
感悟:在金属离子中混有Fe3+离子的提纯过程中,一般加入相应的金属氧化物、氢氧化物、碳酸盐、碱式碳酸盐等为除杂试剂,主要目的是调控溶液pH,促进Fe3+水解转变为Fe(OH)3沉淀分离除去。而加入NaOH、NH3·H2O、Na2CO3等为试剂则不妥,不仅会引入新杂质,而且被提纯的金属离子也可能产生沉淀,达不到提纯除杂的目的。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一、工艺流程题的答题策略 二、化工流程题的结构特点及知识清...
在高考化学的工艺流程题中,萃取与反萃取是一对相辅相成、用...
第一种——酸浸 1 、定义: 是指是用无机酸的水溶液作浸出剂的...
在高考化学的工艺流程题中,“浸...
煅烧: 是天然化合物或人造化合物的热离解或晶形转变过程;此...
...