
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、目的(分离提纯、生产制备)
1.使某些金属离子形成氢氧化物沉淀,或防止某些金属离子形成沉淀;
2.调节溶液的酸碱性,促进或抑制某些离子水解;
3.调节溶液的酸碱性,使某些离子转化为其他离子。
二、计算技巧
1.明确操作目的:从流程图中分析,调节pH前,该步骤中存在的离子,调节的目的是使哪些离子沉淀,哪些离子不能沉淀。
2.需要的数据:
①某些金属阳离子完全沉淀的pH,或Ksp[M(OH)n]
②隐藏的数据:c(Mn2+)≤1.0×10-5mol•L-1时,Mn2+已完全沉淀,有时题目也会作为“已知信息”给出。
③不能沉淀的离子的浓度和Ksp[M(OH)n]
三、调节pH的知识点汇总:
1、调控pH的目的:
(1)抑制盐类的水解,防止产品混入杂质(像盐酸盐、硝酸盐溶液,通过结晶方法制备晶体或加热脱水结晶水合物制备相对应的无水盐时,由于水解生成的盐酸或硝酸挥发,促使了金属离子水解(水解反应为吸热反应)导致产品不纯,如MgCl2·6H2O Mg(OH)Cl+HCl↑+5H2O等,这就需要在酸性氛围中加热来抑制其水解)或促进盐类的水解生成沉淀,有利于过滤分离即为了将XXx转化为沉淀便于分离(调节pH所用试剂为主要元素对应的氧化物、碳酸盐、碱,以避免引入新的杂质);
Mg(OH)Cl+HCl↑+5H2O等,这就需要在酸性氛围中加热来抑制其水解)或促进盐类的水解生成沉淀,有利于过滤分离即为了将XXx转化为沉淀便于分离(调节pH所用试剂为主要元素对应的氧化物、碳酸盐、碱,以避免引入新的杂质);
(2)H+:除去氧化物、碱或其他与H+反应的物质;OH-:除去油污,除去Si、Al元素或与OH-反应的物质等;
(3)为了某些特定的氧化还原反应:例如酸性条件下NO3-有氧化性,S2O32-在酸性条件下发生歧化反应等;
(4)为了制备生成某酸、某碱,或防止某金属离子水解。
2、pH大小后果分析:
(1)pH过小的后果:导致某离子沉淀不完全;小心电化学中,H+浓度过大,会导致金属离子放电程度减小。会增加后续中和物质的消耗。
(2)pH过大的后果:导致主要离子开始沉淀,两性物质溶解等。
pH要考虑:小心两性化合物的变化;小心题中新离子在不同pH条件下的变化;注意CrO42-与Cr2O72-之间的转化
典例分析:

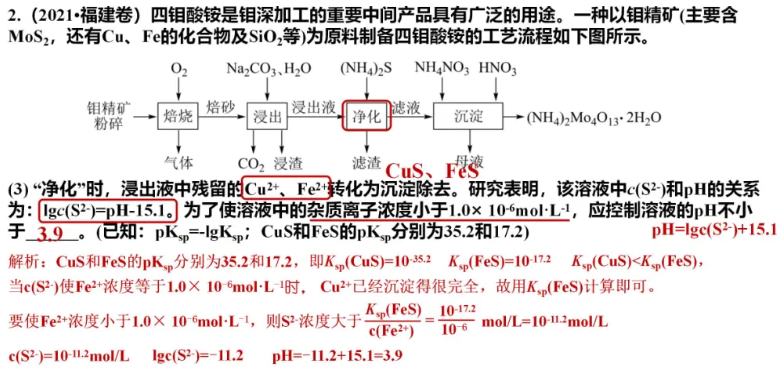
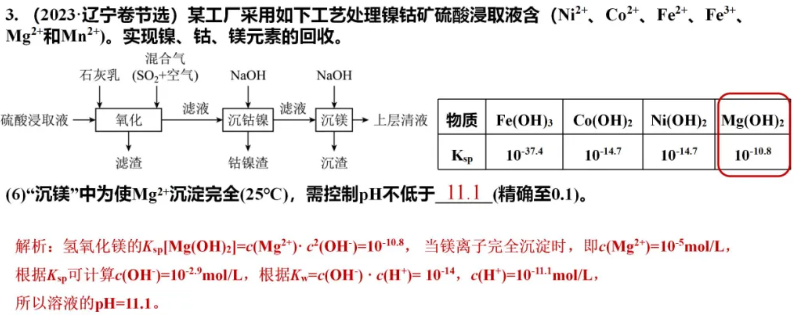
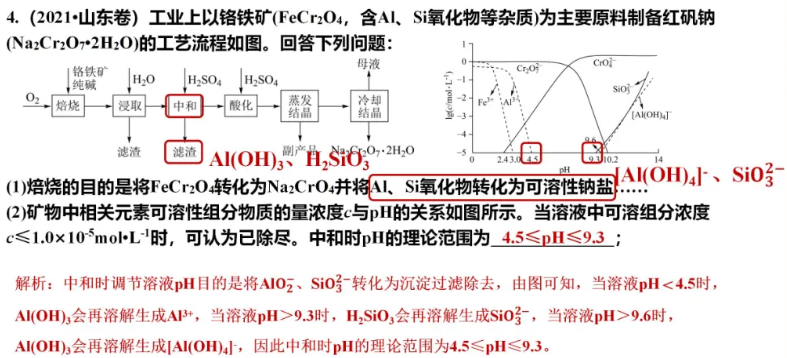

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
在高考化学的工艺流程题中,萃取与反萃取是一对相辅相成、用...
第一种——酸浸 1 、定义: 是指是用无机酸的水溶液作浸出剂的...
在高考化学的工艺流程题中,“浸...
煅烧: 是天然化合物或人造化合物的热离解或晶形转变过程;此...
...
一、钒及其化合物 VB族元素钒(3d 3 4s 2 )的存在形式变化很多。...