
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
关于液态物质在水中溶解平衡的规则大多是定性的和经验性的。一般地说,低极性分子构成的物质或分子中不带有能形成氢键的基团的物质在水中溶解度很小。例如,与醇类具有高度水溶性的性质相反,烃类或卤代烃在水中溶解度是很小的。结构相近而分子较小的物质一般有较大的水溶性,例如苯、甲苯、邻二甲苯三者在水中溶解度递降,分别为1.8、0.51、0.17g/L。至于苯酚、苯、环己烷,虽然它们的分子大小相近,但由于极性有较大差异,所以在水中溶解度分别为70、1.8和0.05g/L。
很多呈液态的有机物质在水中依靠分子间作用力发生物理性溶解。这种分子间作用力有两类,一类是范德华引力,这种力较小,存在于任何分子间;另一类是氢键力,可表示为AH…B,这种力较大,对溶解度有决定性意义。在氢键的表达式中,A和B为电负性大,半径小的原子,如氧、硫、氟、氯、氮等;从电子授受能力来说,AH为受电子基,如—OH、=NH、—SH等;B为给电子基,如—O—、=N—、—F、—S—、—Cl等。基于上述,我们可以将溶剂分为以下五种类型:
N型 是惰性溶剂,它们没有生成氢键的能力。如苯、甲苯、煤油、硅油、石蜡油、四氯化碳、二硫化碳、环己烷、戊烷、己烷、庚烷等。
A型 是受电子型溶剂,分子中含AH基,能与给电子溶剂B的分子生成氢键。如氯代甲烷、氯代乙烷等。
B型 是给电子型溶剂,分子中含B原子,能与另一种溶剂AH的分子生成氢键。如各类醚、酮、醛、腈、酯、季胺、吡啶等。
AB型 是给受电子型溶剂,分子中同时含有AH基和B原子,因此,自身就可缔合成多聚分子。诸如水、多酚、多元醇、多元羧酸类化合物,它们自身缔合成多聚分子是通过交链氢键键合完成的,可定名为AB1型溶剂。另有一类AB2型溶剂,诸如醇、酚、伯胺、羧酸类化合物,它们自身缔合成多聚分子是通过直链氢键键合完成的:
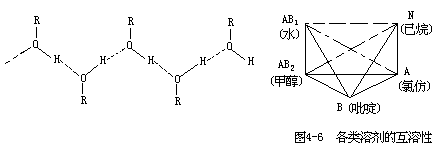
以上几类溶剂相互溶解的能力如图4-6所示。图中以实线相联的两类物质是互溶的,以锁线相联者是部分互溶的,以虚线相联者是不相溶的。当然,属于同一类的物质也是相互可溶的。从图中还可看出,作为AB1型溶剂的水,可溶解AB1、AB2和B型物质,部分溶解A型物质,而不能溶解N型物质。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
常见官能团的优先次序表 类别 序号 官能团 词头名称 词尾名称...
质谱,即质量的谱图, 物质的分子在高真空下,经物理作用或化...
...
第二页 第三页...
关于液态物质在水中溶解平衡的规则大多是定性的和经验性的。...
在测定实验式及相对分子质量后,对于一个有机分子的认识,并...