
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
(2005年全国理综卷第9题):同一主族的两种元素的原子序数之差不可能是(
A
(2006广东,2)同主族两种元素原子核外电子数差值可能为(
A.
笔者在组织学生复习处理以上两题时,很多学生都是采用的验证法,认为这种题型思维量大,每一个选项数值都成了一个较大的计算题,不易整体把握,表现出畏难情绪。
如何突破?这种类型题目到底有多少组数值?如何让学生形成固定的解题模式?这些问题不仅萦绕在学生心中,也引起了笔者的兴趣。透过现象分析本质,此类问题考查实质应为原子核外电子的排布规律。笔者认为此类问题应采用抓住典型,运用有序思维逐一求解。
一、以第ⅠA、ⅦA主族作为典型
通过对元素周期表分析,副族元素在第四周期开始出现,介于ⅡA与ⅢA之间,副族元素的出现影响了主族元素的核外电子排布。在ⅠA~ⅡA、ⅢA~ⅦA其核外电子的排布是有规律可遁的,因此选择ⅠA、ⅦA两主族元素作为解题的典型。利用核外电子排布知识将ⅠA、ⅦA主族元素的电子排布罗列如下:
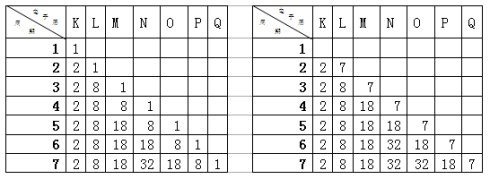
二、运用有序思维,逐一求解
首先以副族元素左边的第ⅠA为例,因是同一主族,最外层电子数目相同,可以省略,如下:
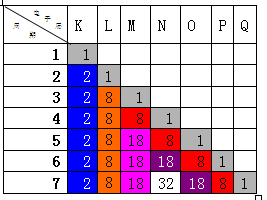
由此可知同主族的第2、3、4、5、6、7周期与第1周期元素的原子序数之差分别为:2;2+8=10;2+8+8=18;2+8+18+8=36;2+8+18+18+8=54;2+8+18+32+18+8=86。
因第2周期同主族元素与第3、4、5、6、7周期元素的K层都具有相同的原子数,因此可以省略。其原子序数差分别为:8;8+8=16;8+18+8=34;8+18+18+8=52;8+18+32+18+8=84。
因第3周期同主族元素与第4、5、6、7周期元素具有相同的L层电子数,因此可以忽略。其原子序数差分别为:8(忽略);18+8=26;18+18+8=44;18+32+18+8=76。
因第4周期同主族元素与第5、6、7周期元素具有相同的次外层电子数,因此可以忽略。其原子序数差分别为:18(忽略);18+18=36(忽略);18+32+18=68。
第5周期同主族元素与第6、7周期元素具有相同的M层,因此可以忽略。其原子序数差分别为:18(忽略); 32+18=50。
第6周期同主族元素与第7周期元素原子序数差为32。
因此同主族两种元素原子序数差可以为:2、8、10、16、18、26、32、34、36、44、50、52、54、68、76、84、86,共17组解。
同理,以副族元素的右边的第ⅦA为例,
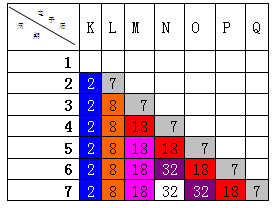
因每1周期未填充元素,所以应先去掉最外层相同的电子数和相同的K层电子数,再依此类推,还可以补充四组数值,分别为:8+18+32+32+18=108;18+32+32+18=100;18+32+32=82;32+32=64。
由此可知此类题目共有21组解。分别为:2、8、10、16、18、26、32、34、36、44、50、52、54、64、68、76、82、84、86、100、108。
三、换种思维方式求解
部分同学受以上思维方式启发,通过对每一周期所容纳的元素种类数进行探讨发现,若是副族元素左边的ⅠA、ⅡA元素,可知同主族相邻元素的差值即为前一周期容纳的元素种类数;若是副族元素右边的ⅢA~ⅦA,同主族相邻元素的差值即为后一周期容纳的元素种类数。
周期 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
容纳元素的种类数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
由此可知,同主族元素的原子序数差值为:2、8、18、32;
2+8=10、2+8+8=18(重复)、2+8+8+18=36、2+8+8+18+18=54、2+8+8+18+18+32=86、2+8+8+18+18+32+32=118(目前元素种类数不足118可以忽略);
8+8=16、8+8+18=34、8+8+18+18=52、8+8+18+18+32=84、8+8+18+18+32+32=116(因目前元素种类数不足118可以忽略);
8+18=26、8+18+18=44、8+18+18+32=76、8+18+18+32+32=108;
18+18=36(重复)、18+18+32=68、18+18+32+32=100;
18+32=50、18+32+32=82;
32+32=64。
同理可知共有21组解。分别为:2、8、10、16、18、26、32、34、36、44、50、52、54、64、68、76、82、84、86、100、108。
通过对此类问题的分析探讨,同学们加深了核外电子排布知识的印象,能够透过现象研究本质,达到了事半功倍的效果。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
本文将给出基于八隅律的电子式的书写步骤。与以往教学不同之...
氯离子(Cl)的半径大于铯离子(Cs)!!!课本上没有错哦!...
含氧酸是酸中的主角,常见的含氧酸中,有高某酸、正某酸、亚...
一、常见三种原子半径的标准 首先我们说说原子半径有几种不同...
【导读】键长和键能的关系在化学中通常表现为反比规律:键长...
...