
|
学习小专题 |
 盐类水解规律及离子方程式的书写
日期:2022-08-05 17:49:43
点击:22878
好评:0
盐类水解规律及离子方程式的书写
日期:2022-08-05 17:49:43
点击:22878
好评:0
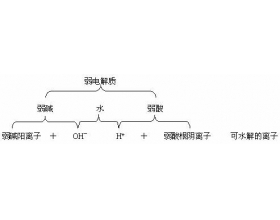
一、盐类水解的四大规律 1. 什么离子水解? 根据盐类水解的定义,知盐类水解的关键是生成了弱电解质。由下图示可知。 因此, 盐中的弱离子 (弱碱阳离子和弱酸根阴离子)一定要发生水解。 2. 什么盐水解? 强酸和弱碱所生成的盐叫强酸弱碱盐,强碱与弱酸所生成的盐叫强碱...
 强碱弱酸盐的pH一定随温度升高而增大吗?
日期:2021-12-02 10:42:42
点击:2765
好评:0
强碱弱酸盐的pH一定随温度升高而增大吗?
日期:2021-12-02 10:42:42
点击:2765
好评:0
...
 高中常见酸的强弱比较
日期:2019-11-13 15:05:28
点击:19087
好评:8
高中常见酸的强弱比较
日期:2019-11-13 15:05:28
点击:19087
好评:8
本文所说的酸性强弱仅针对于高中的酸碱理论,(除此之外,在高中出现的习题中已经对酸碱质子理论有了一定的渗透。)酸性的强弱是根据酸电离出氢离子的能力来衡量的。不同的溶剂对酸碱的电离的影响不同。例如:HCl、HI、硫酸、硝酸、高氯酸等强酸,在水中100%电离,而在...
 如何定量理解越弱越水解?
日期:2019-06-27 15:19:22
点击:2207
好评:0
如何定量理解越弱越水解?
日期:2019-06-27 15:19:22
点击:2207
好评:0
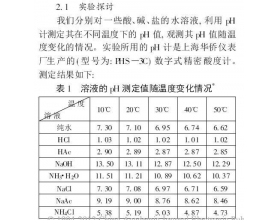
盐类的水解规律中有“谁弱谁水解,越弱越水解”. 在课本“科学视野”栏目中介绍了盐的水解常数,但很多学生却不够重视,殊不知其推导过程能帮助我们更深入的去理解水解规律. 例1 在25 ℃时,等浓度的NaF 溶液pH=a 和NaCN 溶液的pH=b,则a b(填“>”“<”或“=”)(数...
 浓度分别为0.1mol/L的碳酸钠溶液和碳酸氢钠溶液,谁碱性强?
日期:2017-04-06 20:57:57
点击:1432
好评:0
浓度分别为0.1mol/L的碳酸钠溶液和碳酸氢钠溶液,谁碱性强?
日期:2017-04-06 20:57:57
点击:1432
好评:0
...
 对镁与铵盐溶液反应的认识分析
日期:2016-02-02 21:54:47
点击:9894
好评:0
对镁与铵盐溶液反应的认识分析
日期:2016-02-02 21:54:47
点击:9894
好评:0
对于镁铝来讲,二者均是较活泼的金属,从其本身所具有的能力来讲(内因),完全有能力与水发生置换反应放出氢气(EAl 3+ /Al=-2.375V、EMg 2+ /Mg=-1.67V、EH 2 O/H 2 =-0.414V)。但事实上,在通常条件下,镁铝并不与水反应,其原因是因为当镁铝与水反应后,均会生成...
 水解度
日期:2016-02-02 20:19:51
点击:5733
好评:0
水解度
日期:2016-02-02 20:19:51
点击:5733
好评:0
盐类的水解达到平衡时,已水解的盐的分子数与溶解在溶液中的盐的分子总数之比叫盐的水解度.各种盐在相同温度、相同浓度时有不同的水解度.水解生成的酸或碱越弱,则水解度越大.例如,18℃时0.1mol·L -1 醋酸钠溶液的水解度是0.008%,而氰化钾在相同条件下的水解度是...
 盐类的水解反应进行的程度
日期:2016-02-02 20:16:49
点击:8397
好评:0
盐类的水解反应进行的程度
日期:2016-02-02 20:16:49
点击:8397
好评:0
酸碱中和和盐类水解在一定条件下互为可逆,构成矛盾的两个方面,这对矛盾有时这方面成为主要方面,有时候另一方面成为矛盾的主要方面.如何正确理解中和反应和盐类的水解反应的进行程度问题?现分以下几类情况来谈. (1)盐类的水解进行的程度很小:由于中和反应有极弱...
 稀释有利于水解,亦有利于电离
日期:2016-02-02 20:11:42
点击:11679
好评:0
稀释有利于水解,亦有利于电离
日期:2016-02-02 20:11:42
点击:11679
好评:0
为什么 弱电解质溶液加水冲稀 电离平衡右移? 1.在其他条件不变的情况下,向一定浓度的弱电解质溶液中加水,由于水分子数增多,使得弱电解质电离的离子之间的距离增大,离子间相互碰撞结合成分子的机会减小,单位时间内离子间的有效碰撞次数减少。另外,弱电解质分子由于...
 某盐溶液显中性,该盐一定未水解吗?
日期:2012-11-07 09:41:39
点击:4080
好评:0
某盐溶液显中性,该盐一定未水解吗?
日期:2012-11-07 09:41:39
点击:4080
好评:0
某盐溶液显中性,该盐不一定未水解,例如:NaCl溶液显中性,是因为NaCl是强酸强碱盐,不水解。再例如:CH 3 COONH 4 溶液显中性,却是水解的结果。 CH 3 COONH 4 是易溶、易电离的弱酸弱碱盐,根据盐类水解的原理及实质来看,CH 3 COONH 4 确实能水解,CH 3 COO - 水解生成C...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。