
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑f] 水溶液中为什么Cu²⁺(3d⁹)比Cu⁺( 作者:化学自习室 来源:未知 日期:2025-10-11 08:21:11 点击:239 所属专题:铜的稳定性
[注解与辨疑f] 水溶液中为什么Cu²⁺(3d⁹)比Cu⁺( 作者:化学自习室 来源:未知 日期:2025-10-11 08:21:11 点击:239 所属专题:铜的稳定性
【导读】水溶液中Cu(II)比Cu(I)更稳定,这看似与电子排布3d比3d更稳定的直觉相悖,但其是热力学和溶剂效应共同作用的结果。 ①水合能:Cu的高电荷使其具有远比Cu更低(Cu水合能的绝对值更大,其作为负值的“数值”更小更低)的水合能,使体系能量更低更稳定,这是最主要...
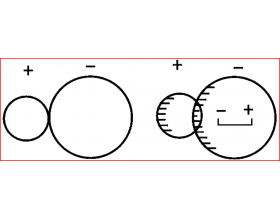 [注解与辨疑f] 什么是离子极化?为什么会有电荷高却熔点低的"离子晶体"? 作者:化学自习室 来源:未知 日期:2025-10-11 08:12:16 点击:228 所属专题:离子极化
[注解与辨疑f] 什么是离子极化?为什么会有电荷高却熔点低的"离子晶体"? 作者:化学自习室 来源:未知 日期:2025-10-11 08:12:16 点击:228 所属专题:离子极化
【导读】离子极化的本质是正离子对负离子电子云的扭曲能力,一般情况下离子极化加强,会导致物质的熔点降低、颜色渐变黄、溶解性下降、共价性增强! 判断其极化强弱时需从正离子的“极化能力”和负离子的“变形性”两个维度考量分析,具体先看正离子的电荷和半径(核心)...
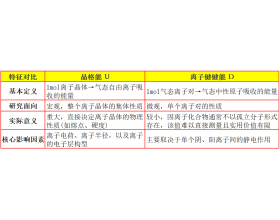 [注解与辨疑f] 离子键键能就是晶格能吗? 作者:化学自习室 来源:未知 日期:2025-10-11 08:09:05 点击:214 所属专题:离子键 晶格能
[注解与辨疑f] 离子键键能就是晶格能吗? 作者:化学自习室 来源:未知 日期:2025-10-11 08:09:05 点击:214 所属专题:离子键 晶格能
【导读】 不是,差别很大。 晶格能 和离子键键能这两个概念都描述“ 把离子晶体拆成离子或原子所需的能量 ”,但 拆的方式不同、参考态不同、所需能量也不同 。 简言之, 晶格能 是把 晶体 拆成 气态离子 需要的能量 (0K ,内能 ); 离子键键能 是把 气相 离子对 分子 ...
 [注解与辨疑f] 乙酸晶胞的真相:深入分析揭示其包含四个分子 作者:化学自习室 来源:未知 日期:2025-09-16 10:29:32 点击:138 所属专题:乙酸晶胞
[注解与辨疑f] 乙酸晶胞的真相:深入分析揭示其包含四个分子 作者:化学自习室 来源:未知 日期:2025-09-16 10:29:32 点击:138 所属专题:乙酸晶胞
专家观点与质疑 乙酸晶胞中究竟包含4个分子还是2个?深入剖析揭示真相。乙酸晶胞实际上包含的是4个乙酸分子。然而,有些老师提出了疑问,为什么乙酸晶胞中不是包含2个分子,而是4个。这些老师推测,可能是受到了人教版教材的影响,因为教材中似乎暗示乙酸晶胞只含有2个...
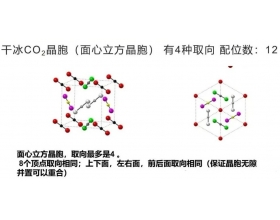 [注解与辨疑f] 分子晶体晶胞中分子取向问题 作者:化学自习室 来源:未知 日期:2025-08-10 09:54:11 点击:173 所属专题:分子晶体 分子取向
[注解与辨疑f] 分子晶体晶胞中分子取向问题 作者:化学自习室 来源:未知 日期:2025-08-10 09:54:11 点击:173 所属专题:分子晶体 分子取向
...
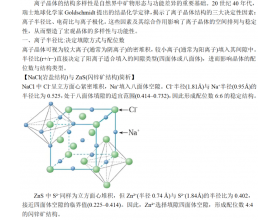 [注解与辨疑f] 离子晶体的结构是什么因素决定的? 作者:化学自习室 来源:未知 日期:2025-08-06 10:21:07 点击:156 所属专题:离子晶体
[注解与辨疑f] 离子晶体的结构是什么因素决定的? 作者:化学自习室 来源:未知 日期:2025-08-06 10:21:07 点击:156 所属专题:离子晶体
...
 [注解与辨疑f] 为什么氧化镁的熔点比氧化铝的熔点高? 作者:化学自习室 来源:未知 日期:2025-08-06 09:48:08 点击:166 所属专题:晶体熔点
[注解与辨疑f] 为什么氧化镁的熔点比氧化铝的熔点高? 作者:化学自习室 来源:未知 日期:2025-08-06 09:48:08 点击:166 所属专题:晶体熔点
...
 [注解与辨疑f] 过渡晶体和混合晶体解读 作者:化学自习室 来源:未知 日期:2025-07-02 18:40:36 点击:491 所属专题:过渡晶体 混合晶体
[注解与辨疑f] 过渡晶体和混合晶体解读 作者:化学自习室 来源:未知 日期:2025-07-02 18:40:36 点击:491 所属专题:过渡晶体 混合晶体
过渡晶体 1.过渡晶体的定义 介于典型晶体之间的晶体 纯粹的典型晶体是不多的! 大多数晶体是典型晶体之间的晶体 2.离子键百分数 离子键的百分数取决于电负性的差值,电负性差值越大,离子键的百分数越大。 第三周期元素的氧化物中,化学键中离子键成分的百分数 (1)四...
 [注解与辨疑f] 为什么氯化钠、氯化镁、氯化铝的熔沸点依次降低? 作者:化学自习室 来源:未知 日期:2025-06-23 18:21:59 点击:298 所属专题:离子晶体
[注解与辨疑f] 为什么氯化钠、氯化镁、氯化铝的熔沸点依次降低? 作者:化学自习室 来源:未知 日期:2025-06-23 18:21:59 点击:298 所属专题:离子晶体
Na + 、Mg 2+ 、Al 3+ 的离子半径依次减小,电荷数依次增多,可是NaCl、MgCl 2 、AlCl 3 的熔点却依次降低,分别为801℃、714℃、192.4℃;沸点也依次降低,依次为1443℃、1000℃、177.8℃。 从离子极化理论解释:离子极化作用的影响因素,即离子的半径越...
 [注解与辨疑f] 为什么氧化镁的熔点比氧化铝的熔点高? 作者:化学自习室 来源:未知 日期:2025-06-17 06:31:39 点击:444 所属专题:氧化铝
[注解与辨疑f] 为什么氧化镁的熔点比氧化铝的熔点高? 作者:化学自习室 来源:未知 日期:2025-06-17 06:31:39 点击:444 所属专题:氧化铝
【导读】MgO熔点为2852℃;AlO熔点为2050–2054℃。 在对比中发现MgO中Mg半径比Al半径大,离子晶体中,离子半径越小,离子间的距离越近,离子键越强;Al所带电荷数比Mg多,从电荷数看,AlO中离子键应更强,熔点应该更高,而事实恰恰相反。 首先主导因素是离子键百分数,...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【导读】水溶液中Cu(II)比Cu(I)更稳定,这看似与电子排布3d比3d更稳定的直觉相悖,但...
【导读】 不是,差别很大。 晶格能 和离子键键能这两个概念都描述“ 把离子晶体拆成离...
专家观点与质疑 乙酸晶胞中究竟包含4个分子还是2个?深入剖析揭示真相。乙酸晶胞实际...
...
...
Na + 、Mg 2+ 、Al 3+ 的离子半径依次减小,电荷数依次增多,可是NaCl、MgCl 2 、A...
【导读】MgO熔点为2852℃;AlO熔点为2050–2054℃。 在对比中发现MgO中Mg半径比Al半径...
一、面心立方最密堆积 面心立方最密堆之中,八面体间隙位于 棱 心和体心,如上图可知...