
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑f] 金属同非金属的区别 作者:王欣华 来源:未知 日期:2016-01-30 14:34:55 点击:6965 所属专题:金属通性
[注解与辨疑f] 金属同非金属的区别 作者:王欣华 来源:未知 日期:2016-01-30 14:34:55 点击:6965 所属专题:金属通性
金属同非金属的区别,主要表现在以下几方面: (1)原子结构 金属原子的外层电子构型一般为ns 1-2 或ns 2 np 1-4 或(n-1)d 1-10 ns 1-2 ,最外层电子数较少(少数最外层电子数较多的金属元素,其电子层数也较多),原子半径比同周期非金属元素大。非金属元素原子的外层电子...
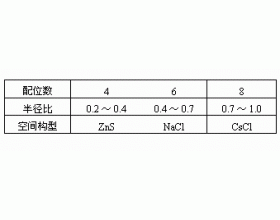 [注解与辨疑f] 离子晶体中离子的配位数 作者:爱莉 来源:未知 日期:2022-04-06 17:35:15 点击:9305 所属专题:离子晶体 晶胞配位数
[注解与辨疑f] 离子晶体中离子的配位数 作者:爱莉 来源:未知 日期:2022-04-06 17:35:15 点击:9305 所属专题:离子晶体 晶胞配位数
与中心离子(或原子)直接成键的离子(或原子)称为配位离子(或原子)。配位离子(或原子)的数目称为配位数,如在氯化钠晶体中,钠和氯的配位数都是6。离子晶体是通过离子键结合而成的,离子键的一个特点是没有方向性。离子是一个带电的质点(近似地认为是球体),根据静电学理...
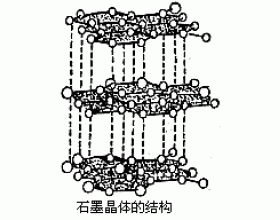 [注解与辨疑f] 混合型晶体 作者:童建军 来源:未知 日期:2016-01-30 14:41:14 点击:6929 所属专题:混合型晶体 石墨
[注解与辨疑f] 混合型晶体 作者:童建军 来源:未知 日期:2016-01-30 14:41:14 点击:6929 所属专题:混合型晶体 石墨
混合型晶体之一 除四种基本晶体类型外,还有一系列过渡型晶体,因为这些晶体中微粒间的作用力不只一种,所以常称为混合键型晶体。常见的混合键型晶体有层状结构和链状结构两种。石墨是一种典型的层状混合键型晶体,层内碳原子间有金属键,相邻碳原子间有共价键,层间有...
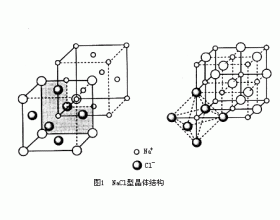 [注解与辨疑f] AB型离子晶体的结构 作者:王欣华 来源:未知 日期:2017-04-25 16:06:17 点击:6659 所属专题:氯化钠晶胞 氯化铯晶胞 硫化锌晶胞
[注解与辨疑f] AB型离子晶体的结构 作者:王欣华 来源:未知 日期:2017-04-25 16:06:17 点击:6659 所属专题:氯化钠晶胞 氯化铯晶胞 硫化锌晶胞
组成比为1∶1的离子晶体称为AB型离子晶体,它是离子晶体中最简单的一类。AB型离子晶体最常见的基本结构有NaCl型、CsCl型和ZnS型。 (1)NaCl型 NaCl型离子晶体中,每个离子被6个带相反电荷的离子包围,阴离子和阳离子的配位数都为6。常见的NaCl型离子晶体有碱金属元素(铯...
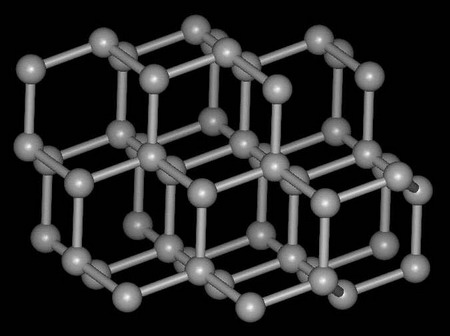 [注解与辨疑f] 什么是金属键? 作者:耿艳 来源:未知 日期:2016-01-30 14:43:30 点击:19058 所属专题:金属键 金属晶体
[注解与辨疑f] 什么是金属键? 作者:耿艳 来源:未知 日期:2016-01-30 14:43:30 点击:19058 所属专题:金属键 金属晶体
一、金属离子跟自由电子间较强的作用使许多金属离子互相结合在一起的化学键,叫金属键。 说明:(1)金属键没有方向性和饱和性。 (2)由金属键形成的晶体是金属晶体。 在金属晶体里的金属离子跟自由电子之间存在较强的作用,因而使许多金属离子互相结合在一起,通过这...
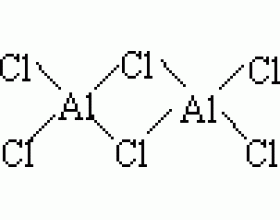 [注解与辨疑f] 中学化学晶体结构中常见的几个问题 作者:吴键 来源:未知 日期:2016-01-30 14:46:42 点击:22000 所属专题:晶体结构
[注解与辨疑f] 中学化学晶体结构中常见的几个问题 作者:吴键 来源:未知 日期:2016-01-30 14:46:42 点击:22000 所属专题:晶体结构
一、为什么AlCl 3 是共价化合物 金属元素与非金属元素形成的化合物通常是离子化合物,如NaCl、K 2 S等,但AlCl 3 是共价化合物。AlCl 3 的熔点192.4℃(2.5个大气压),沸点为177.8℃(沸点比熔点低是因为测定AlCl 3 熔点需加压,因而使得熔点升高)。AlCl 3 在熔融态、...
 [注解与辨疑f] 硬度、脆性、韧性、延性、展性和弹性 作者:胡长胜 来源:未知 日期:2018-04-12 16:55:56 点击:13488 所属专题:金属通性 硬度
[注解与辨疑f] 硬度、脆性、韧性、延性、展性和弹性 作者:胡长胜 来源:未知 日期:2018-04-12 16:55:56 点击:13488 所属专题:金属通性 硬度
硬度(Hardness) -是材料抵抗外物刺入的一种能力。用硬度试验器来试验是现代试验硬度常用的方法。最常用的试验法有洛氏硬度试验洛氏硬度试验机利用钻石冲入金属的深度来测定金属的硬度,冲入深度愈大,硬度愈...
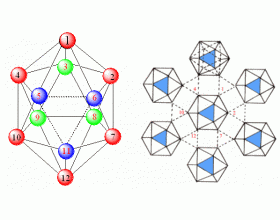 [注解与辨疑f] α-菱形硼(B12)的结构 作者:章金莲 来源:未知 日期:2019-05-27 08:48:08 点击:24837 所属专题:硼单质
[注解与辨疑f] α-菱形硼(B12)的结构 作者:章金莲 来源:未知 日期:2019-05-27 08:48:08 点击:24837 所属专题:硼单质
α-菱形硼(B 12 )的结构 由于硼的缺电子特征,其晶体结构在所有元素中具有最特殊的复杂性。α-菱形硼(B 12 )的结构单元是正二十面体,形成多中心缺电子键,形成 多 面体。B 12 见上图。 价电子数:在B 12 中,每个硼原子有3个价电子,因此B 12 中有3× 12 = 36个价电子...
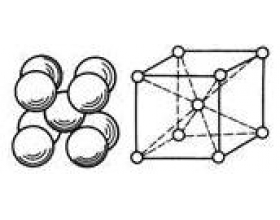 [注解与辨疑f] 金属晶体释疑 作者:章金莲 来源:山东省平度市第六中学 日期:2016-01-30 14:49:49 点击:13284 所属专题:金属晶体
[注解与辨疑f] 金属晶体释疑 作者:章金莲 来源:山东省平度市第六中学 日期:2016-01-30 14:49:49 点击:13284 所属专题:金属晶体
1.金属晶体如何形成的? 由于金属原子的价电子比较少,容易失去价电子成为金属离子 ( 带电荷的金属原子 ) .这些释出来的价电子称为自由电子.自由电子不专属于某个特定的金属离子,而为整个金属晶体所共有,它们在整个晶体里自由地运动着,形成了自由电子的“海洋”....
 [注解与辨疑f] 石墨的熔点比金刚石的熔点高,但两者的沸点相同 作者:赵斌 来源:未知 日期:2020-04-08 16:58:50 点击:20920 所属专题:石墨 金刚石
[注解与辨疑f] 石墨的熔点比金刚石的熔点高,但两者的沸点相同 作者:赵斌 来源:未知 日期:2020-04-08 16:58:50 点击:20920 所属专题:石墨 金刚石
金刚石的熔点是3550℃,沸点是4827℃;石墨的熔点是3652℃~3697℃(升华),沸点是4827℃。从上述的数据可知石墨熔点高于金刚石,但两者的沸点相同。 从层内部来看,石墨是原子晶体;从层层之间来看,石墨是分子晶体(总体说来,石墨应该是混合型晶体)。金刚石是原子晶...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、面心立方最密堆积 面心立方最密堆之中,八面体间隙位于 棱 心和体心,如上图可知...
1. Cu 、Fe交错 一种CuFeS 2 (黄铜矿)的 四方晶系 晶胞结构如图。 如果将该晶体中的...
在目前有些资料中,提及石墨中含有金属键。下面我们通过4种版本(人教版、鲁科版、苏...
金刚石硬度比石墨大得多,缘于金刚石的“均匀一体化”的空间网状结构,无论从哪个方向...
键能,常见有共价键的键能:使1mol 某共价键断裂所需的能量(键焓,kJ/mol)。 不说离子...
01原子结构 HCP,即密排六方晶格(Hexagonal Close Packed),是晶体结构的一种,其原...
硬度(Hardness) -是材料抵抗外物刺入的一种能力。用硬度试验器来试验是现代试验硬度常...
现行高中教材给出二氧化硅晶体的平面结构如下图1。该示意图准确地表示了二氧化硅晶体...