
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑j] 等浓度(或pH)的碳酸钠与亚硫酸钠稀释情况分析 作者:李文才 来源:未知 日期:2015-01-28 09:36:00 点击:1578 所属专题:盐类水解应用
[注解与辨疑j] 等浓度(或pH)的碳酸钠与亚硫酸钠稀释情况分析 作者:李文才 来源:未知 日期:2015-01-28 09:36:00 点击:1578 所属专题:盐类水解应用
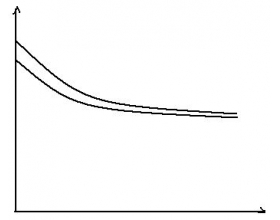
等浓度的碳酸钠与亚硫酸钠稀释情况分析如图: (上面为碳酸钠,下面为亚硫酸钠) 等pH的碳酸钠与亚硫酸钠稀释情况分析如图: (下面为碳酸钠,上面为亚硫酸钠) 相同pH相同体积的三种盐稀释相同倍数后pH变化如图,如何判断三种酸的酸性强弱? HX最弱,把盐当碱看,强碱...
 [注解与辨疑j] 氯化铵溶液中加醋酸铵固体,pH怎么变化? 作者:耿艳 来源:未知 日期:2021-06-18 17:16:42 点击:2529 所属专题:盐类水解应用
[注解与辨疑j] 氯化铵溶液中加醋酸铵固体,pH怎么变化? 作者:耿艳 来源:未知 日期:2021-06-18 17:16:42 点击:2529 所属专题:盐类水解应用
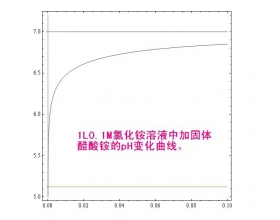
氯化铵溶液中加醋酸铵固体,pH怎么变化?铵根离子浓度增大,水解产生氢离子浓度变大,但 醋酸根离子结合氢离子又减...
 [注解与辨疑j] 过氧化钠为什么对水的电离促进? 作者:王世坤 来源:未知 日期:2015-01-28 09:10:32 点击:2021 所属专题:过氧化钠 水的电离
[注解与辨疑j] 过氧化钠为什么对水的电离促进? 作者:王世坤 来源:未知 日期:2015-01-28 09:10:32 点击:2021 所属专题:过氧化钠 水的电离
能消耗水中的氢离子或是氢氧根离子的反应都可以促进。过氧化钠其实是双氧水的正盐。而双氧水是弱酸。所以在本质上过氧化钠是强碱弱酸盐。要水解。水解在本质上就是促进水的电离。...
 [注解与辨疑j] 温度越高,酸的pH越小,碱的pH越大吗? 作者:罗云峰 来源:未知 日期:2015-01-27 17:27:54 点击:2311 所属专题:水的电离
[注解与辨疑j] 温度越高,酸的pH越小,碱的pH越大吗? 作者:罗云峰 来源:未知 日期:2015-01-27 17:27:54 点击:2311 所属专题:水的电离
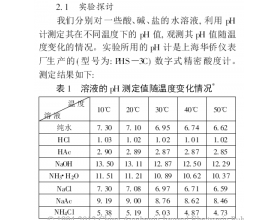
温度越高,酸的pH越小,碱的pH越大吗?很显然从图表得知不一定,因为不能单纯考虑酸碱盐的变化情况,还有考虑到水的电离情况的变化。...
 [注解与辨疑j] 恒温下向CH3COONa稀溶液中加入少量固体醋酸钠,c(CH3COO-)/c(Na+ 作者:吴乾环 来源:未知 日期:2015-01-27 15:38:58 点击:1231 所属专题:盐类水解
[注解与辨疑j] 恒温下向CH3COONa稀溶液中加入少量固体醋酸钠,c(CH3COO-)/c(Na+ 作者:吴乾环 来源:未知 日期:2015-01-27 15:38:58 点击:1231 所属专题:盐类水解
请教:恒温下向CH 3 COONa稀溶液中加入少量固体醋酸钠 c (CH 3 COO - )/ c (Na + )比值增大吗? 一般讲离子浓度比值的题都用极限法。比如这个题,开始醋酸根比钠离子比值是小于一的,后来加入醋酸钠固体,如果加了无限多的醋酸钠,这个体系就变成醋酸钠了。那么离子浓度比...
 [注解与辨疑j] 为什么计算只考虑氢氧化铁的溶解平衡,不考虑电离平衡? 作者:赵胜 来源:未知 日期:2015-01-27 15:21:56 点击:2449 所属专题:氢氧化铁 溶解平衡 电离平衡
[注解与辨疑j] 为什么计算只考虑氢氧化铁的溶解平衡,不考虑电离平衡? 作者:赵胜 来源:未知 日期:2015-01-27 15:21:56 点击:2449 所属专题:氢氧化铁 溶解平衡 电离平衡
氢氧化铁的溶液一般只考虑沉淀溶解平衡,而不去考虑弱电解质的电离平衡了,为啥?比如计算三价铁的量,直接用Ksp,而不管电离常数了。 溶解的氢氧化铁是完全电离的。氢氧化铁不是弱的吗?溶解的怎么是全部电离的?完全电离为什么还是弱电解质?碳酸钙硫酸钡不都算强电解质么...
 [注解与辨疑j] 常温下,浓度均为a的CH3COOH和CH3COONa混合液为什么显酸性? 作者:古盛兰 来源:未知 日期:2014-09-15 16:27:41 点击:962 所属专题:酸碱性
[注解与辨疑j] 常温下,浓度均为a的CH3COOH和CH3COONa混合液为什么显酸性? 作者:古盛兰 来源:未知 日期:2014-09-15 16:27:41 点击:962 所属专题:酸碱性
证明:已知25℃时CH 3 COOH的电离平衡常数 K a 约为1.75×10 ─5 , CH 3 COOH会发生电离,使溶液显酸性;CH 3 COONa会发生水解,使溶液显碱性。 因此,该混合液的酸碱性就取决于该混合液中CH 3 COOH电离产生 c (H + )与CH 3 COONa水解产生 c (OH ─ )的相对大...
 [注解与辨疑j] 常温下,浓度均为a的NH3H2O和NH4Cl混合液为什么显碱性? 作者:安勃 来源:未知 日期:2014-09-15 16:35:30 点击:1004 所属专题:酸碱性判断
[注解与辨疑j] 常温下,浓度均为a的NH3H2O和NH4Cl混合液为什么显碱性? 作者:安勃 来源:未知 日期:2014-09-15 16:35:30 点击:1004 所属专题:酸碱性判断
证明:已知25℃时NH 3 H 2 O的电离平衡常数 K b 约为1.76×10 ─5 , NH 3 H 2 O会发生电离,使溶液显碱性;NH 4 Cl会发生水解,使溶液显酸性。 因此,该混合液的酸碱性就取决于该混合液中NH 3 H 2 O电离产生 c (OH─)与NH 4 Cl水解产生 c (H + )的相对大...
 [注解与辨疑j] 非盐的水解反应---剧烈、放热、完全 作者:刘艳香 来源:未知 日期:2016-03-22 14:58:46 点击:1202 所属专题:非盐水解反应
[注解与辨疑j] 非盐的水解反应---剧烈、放热、完全 作者:刘艳香 来源:未知 日期:2016-03-22 14:58:46 点击:1202 所属专题:非盐水解反应
了解非盐类的水解,首先要区别于盐类的水解! 回忆:盐类的水解--在水溶液里,盐电离出的弱离子与水电离出的离子形成弱电解质的反应。特点是微弱、可逆、吸热。前提是盐能溶于水中,并电离出弱离子。 非盐类的水解则能发生剧烈、完全、放热的一类化合物。此类化合物可...
 [注解与辨疑j] 金属离子沉淀PH值 作者:丁萍 来源:未知 日期:2019-05-23 10:36:24 点击:15560 所属专题:沉淀分析法 金属离子沉淀ph值 化工条件控制
[注解与辨疑j] 金属离子沉淀PH值 作者:丁萍 来源:未知 日期:2019-05-23 10:36:24 点击:15560 所属专题:沉淀分析法 金属离子沉淀ph值 化工条件控制
金属离子沉淀PH值表格(20℃) 金属离子浓度 10^-1 10^-2 10^-3 10^-4 10^-5 pKsp In 3.27 3.6 3.93 4.26 4.59 33.2 Sn(二价离子) 0.57 1.07 1.57 2.07 2.57 27.8 Sn(四价离子) 0.25 0.5 0.75 1 1.25 56 Cd 7.7 8.2 8.7 9.2 9.7 13.6 Pb(二价离子) 7.04 7.54 8.04 8.54 9....
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。1、 碳酸氢钠溶液pH计算公式的推导 注意: 值得注意的是,最后推导的公式从表面上看c(...
溶解度和溶度积换算 溶解度和溶度积均可以定量表示难溶物质的溶解性。 溶解度与溶度积...
...
酸碱滴定法 强酸滴定强碱的反应 强酸滴定弱碱的反应 混合碱的滴定(双指示剂法+滴定突...
【学生疑问】 教材上有两个实验,一个是 AgI 转化为 Ag 2 S,一个是 Mg(OH) 2 转化为 ...
25 ℃ 时, K a1 (H 2 S)=1.1 × 10 -7 ; K a2 (H 2 S)=1.3 × 10 -13 . (高等教育...
沉淀转化是沉淀溶解平衡的应用之一。 对于溶度积较大的沉淀转为溶度积较小的沉淀这类...
1.实例 常温下,用0.100 0 mol·L -1 NaOH溶液滴定20.00 mL 0.100 0 mol·L -1 CH 3...